Fernanda Marques Rodrigues1, Fernanda Ferreira Correa1,2, Priscila Sala Kobal1,2
1Centro Universitário São Camilo, São Paulo, SP, Brasil
2Universidade de São Paulo (USP), São Paulo, SP, Brasil
Recebido em: 16 de janeiro de 2024; Aceito em: 29 de maio de 2024.
Correspondência: Fernanda Marques Rodrigues, fmrodrigues004@gmail.com
Como citar
Rodrigues FM, Correa FF, Kobal PS. Doença celíaca refratária: uma revisão integrativa. Nutr Bras. 2024;23(1):772-785. doi:10.62827/nb.v23i1.3002
Resumo
Introdução: A doença celíaca (DC) é uma enteropatia crônica imunomediada do intestino delgado, caracterizada por perfis sorológico e histológico específicos, impulsionados pela ingestão de glúten por indivíduos geneticamente predispostos. O processo inflamatório leva à atrofia das vilosidades da mucosa do intestino delgado. A doença celíaca não responsiva (DCNR) é identificada pela referida atrofia diante da ineficácia do tratamento dietético estrito. A persistência deste quadro por mais de 12 meses define a doença celíaca refratária (DCR). Objetivo: apresentou-se as características da DCR. Métodos: revisão integrativa de literatura baseada em artigos indexados nas bases de dados SciELO, BVS e MEDLINE/PubMed, publicados entre 2012 e 2022, com os descritores “doença celíaca refratária” e “doença celíaca” em português, inglês e espanhol. Resultados: foram selecionados 15 estudos que descreveram os subtipos, etiologia, fisiopatologia, epidemiologia, sinais e sintomas, diagnóstico e tratamento da DCR. A DCR tem etiologia multifatorial, resultante da interação entre fatores ambientais, genéticos e imunológicos. A fisiopatologia se baseia na imunidade e a desnutrição é um sintoma crônico. O tratamento se fundamenta na dieta sem glúten somada a terapias farmacológicas. Conclusão: a identificação da DCR requer melhores ferramentas diagnósticas. As terapias adjuvantes ao tratamento dietético apresentam resultados pouco satisfatórios.
Palavras-chave: Doença celíaca; Dieta livre de glúten; Glutens.
Abstract
Introduction: celiac disease (CD) is a chronic immune-mediated enteropathy of the small intestine, characterized by specific serological and histological profiles, driven by gluten ingestion by genetically predisposed individuals. The inflammatory process leads to small intestine mucosa villous atrophy. Non-responsive celiac disease (NRCD) is identified by the refered atrophy due to the strict dietary treatment ineffectiveness. The persistence of this condition for more than 12 months defines refractory celiac disease (RCD). Objective: to present the characteristics of RCD. Methods: integrative literature review based on articles indexed in SciELO, BVS and MEDLINE/PubMed electronic databases, published between 2012 and 2022, with the descriptors “refractory celiac disease” and “celiac disease” in Portuguese, English and Spanish. Results: fifteen studies were selected, which described the subtypes, etiology, pathophysiology, epidemiology, signs and symptoms, diagnosis and treatment of RCD. RCD has a multifactorial etiology, resulting from the interaction between environmental, genetic and immunological factors. Pathophysiology is based on immunity and malnutrition is a chronic symptom. The treatment is based on a gluten-free diet in addition to pharmacological therapies. Conclusion: the identification of RCD requires better diagnostic tools. Adjunctive therapies to dietary treatment show unsatisfactory results.
Keywords: Celiac disease; Gluten-free diet; Glutens.
Introdução
A doença celíaca (DC) é definida como uma enteropatia crônica imunomediada do intestino delgado, caracterizada por perfis sorológicos e histológicos específicos, impulsionados e sustentados pela ingestão de glúten por indivíduos geneticamente predispostos. O processo inflamatório mediado pelas células T leva à atrofia das vilosidades da mucosa do intestino delgado, causando má absorção de nutrientes [1,2].
Hoje a DC é reconhecida como uma doença autoimune sistêmica que pode se desenvolver em qualquer idade. É associada a uma morbidade variável e não específica e ao aparecimento de complicações resultantes de carências nutricionais, incluindo doenças malignas do trato gastrointestinal, razões pelas quais vêm sendo considerada um problema de saúde pública mundial [3,4]. A apresentação clínica dos pacientes com DC é variável e pode incluir sintomas intestinais, extra-intestinais e de síndrome de má absorção, embora os sinais clínicos também possam ser sucintos ou até ausentes O diagnóstico da doença baseia-se em um conjunto de achados clínicos e histopatológicos do intestino delgado e detecção de autoanticorpos associados à DC [2,5].
O tratamento consiste em uma dieta sem glúten (DSG), que costuma ser eficaz, levando à cicatrização da mucosa intestinal e resolução dos sintomas. Contudo, alguns indivíduos experimentam sintomas gastrointestinais contínuos ou recorrentes, com atrofia das vilosidades, apesar da adesão estrita à DSG, e são considerados indívíduos com doença celíaca não responsiva (DCNR) [6].
A cicatrização lenta ou incompleta da mucosa pode ser atribuída à ingestão acidental de glúten por indivíduos com DCNR. No entanto, se a ingestão de glúten e outras etiologias associadas a DC forem excluídas, e os sintomas persistentes durarem mais que 12 meses, o paciente torna-se refratário e é reconhecida a doença celíaca refratária (DCR) [6,7]. Ou seja, a DCR é uma complicação rara da DC e é definida como a recorrência ou persistência de sintomas e sinais de má absorção, com atrofia vilositária intestinal contínua, por mais de 12 meses, apesar de uma estrita DSG [8]. Seu diagnóstico só deve ser feito após exclusão de outras doenças de dano intestinal persistente com atrofia de vilosidades e má absorção. Entretanto, apesar de rara, a DCR é grave pois tem alto risco de progressão para um linfoma de células T associado a enteropatia (LTAE) [7,8,9].
Considerando a dificuldade do diagnóstico da DCR, a complexidade do tratamento, a severidade do prognóstico, bem como a relevância do fator nutricional como, concomitantemente, parte do gatilho e do tratamento da doença, é substancial compreender sua magnitude e repercussões na saúde e na qualidade de vida dos indívíduos diagnosticados com a doença, para possibilitar um enfoque nutricional assertivo. Diante do exposto, o presente estudo identificou e descreveu, por meio de uma revisão da literatura, os aspectos relacionados ao diagnóstico e tratamento da DCR.
Métodos
Revisão de literatura para descrever a abordagem nutricional e terapêutica da DCR. A pesquisa foi realizada em 17 e 18 de julho de 2022. Utilizou-se diretrizes e artigos indexados nas seguintes bases de dados: Scientific Electronic Library Online (SciELO), Biblioteca Virtual em Saúde (BVS) e National Library of Medicine (MEDLINE/PubMed). Os descritores utilizados foram “doença celíaca”, “dieta livre de glúten” e “glutens” e seus correspondentes em inglês, “celiac disease”, “gluten-free diet”, “glutens” e em espanhol, “enfermedad celíaca”, “dieta sin gluten” e “glútenes”, valendo-se da técnica booleana “and”. Foram considerados critérios de elegibilidade para inclusão dos estudos: (i) estudos de revisão, revisão sistemática, ensaios clínicos, metanálises, ensaios controlados randomizados e diretizes que abordassem a DCR; (ii) idiomas espanhol, inglês e português; (iii) publicações entre os anos de 2012 e 2022; (iv) publicações com resumos e texto inteiros disponíveis nas bases selecionadas. Como critérios de exclusão foram excluídos: (i) artigos repetidos nas bases selecionadas; (ii) estudos que tratassem exclusivamente de outros tipos de DC e/ou doenças relacionadas ao glúten, (iii) estudos que não atendessem aos critérios de inclusão.
Resultados
Na busca realizada (Figura 1) foram encontrados 77 trabalhos, dos quais, 15 foram utilizados nesta revisão (quadro 1).
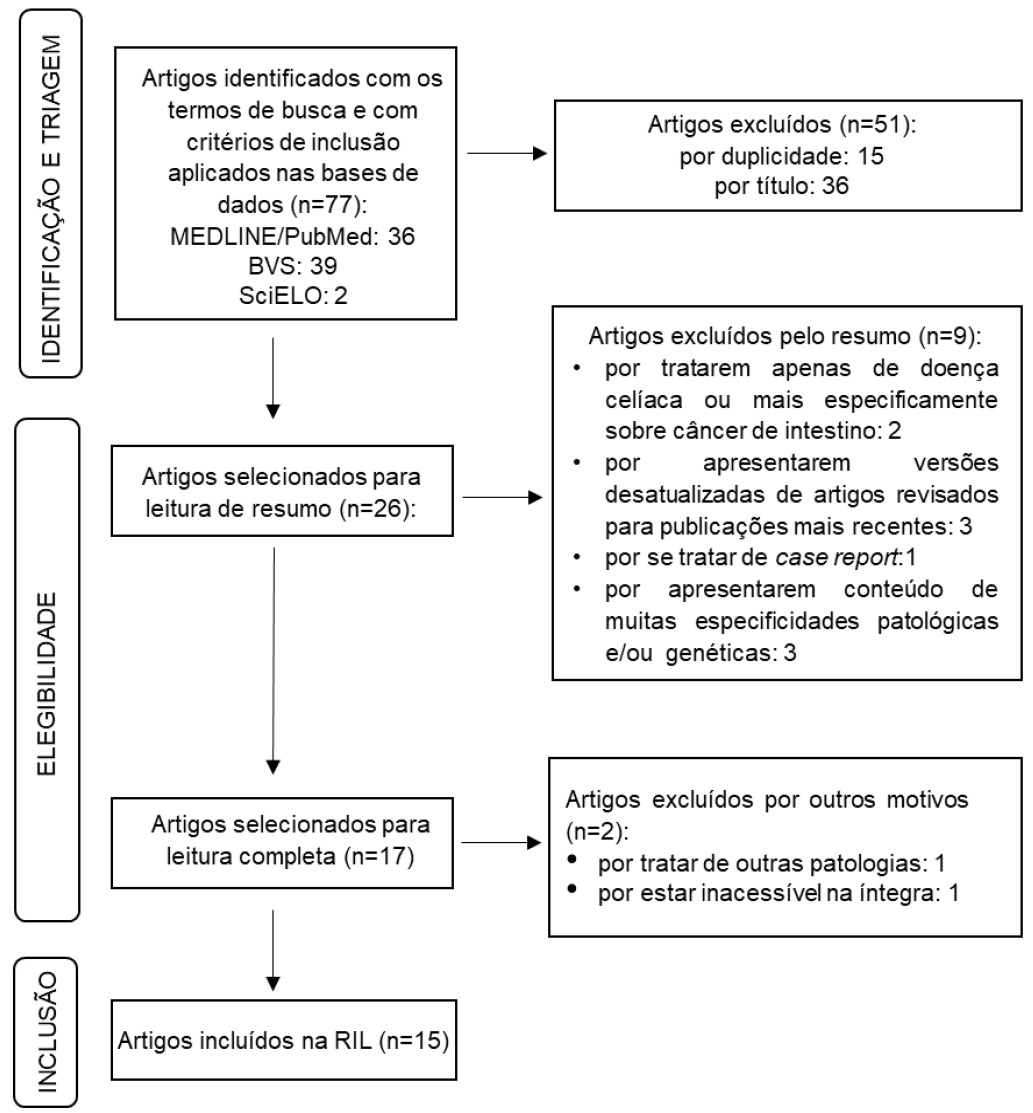
Fonte: Adaptado do fluxograma PRISMA 2020 [11]. RIL: revisão integrativa da literatura
Figura 1 - Passo a passo da metodologia da revisão integrativa da literatura
Após aplicação dos critérios de exclusão, foram selecionados 15 estudos para a presente revisão (quadro 1). Tais estudos trazem as principais características da DCR, englobando desde sua etiologia até as possibilidades mais recentes de tratamento.
Quadro 1 - Apresentação da síntese de artigos incluídos
Discussão
A DCR é dividida em dois subtipos que podem ser distintos clínica, histologica e molecularmente. Tal distinção é fundamental pois as opções de tratamento e prognóstico diferem significativamente. Pacientes com DCR I (imunofenótipo normal), geralmente respondem a uma DSG continuada, somada a um suporte nutricional e ao uso de agentes terapêuticos adequados como corticosteróides. Em contraste, a DCR II (imunofenótipo aberrante), marcada pela presença de uma população de células T clonais aberrantes, está associada a mau prognóstico e tem sido referida como pré-linfoma e/ou linfoma de baixo grau devido ao risco de transformação em LTAE, não apresentando boa resposta clínica ao mesmo tratamento dado à DCR I [12].
A DC é uma das doenças autoimunes mais comuns, com uma prevalência relatada de 0,5-1% da população geral adulta [13]. A prevalência e a incidência mundiais da DCR são desconhecidas e grande parte da literatura é extraída de centros terciários internacionais, introduzindo vieses nas estimativas. Estudo de centros especializados descreveram a prevalência de DCR em 1,5 a 10% entre os indivíduos com DC e 8-23% entre aqueles com DCNR [6]. No entanto, estudos populacionais relatam uma prevalência muito menor de DCR, qual seja, 0,31 a 0,38% entre os celíacos e 0,002% na população geral [8]. Além disso, desde o ano de 2000, parece que o número de casos de DCR vem diminuindo, talvez devido a uma maior conscientização sobre a DC [8]. O DCR I é mais comum que a DCR II, representando 75% de todos os casos de DCR. A progressão de DCR I para DCR II é rara [6].
A DC tem etiologia multifatorial, resultante da interação entre fatores ambientais (glúten), genéticos e imunológicos e sua fisiopatologia baseia-se na imunidade. A DC é uma enteropatia crônica do intestino delgado, imunomediada e precipitada pela exposição ao glúten em indivíduos geneticamente predispostos [1,13].
A DC tem um forte componente hereditário, mas o fenótipo da DC varia por razões não completamente compreendidas. A maioria das pessoas com DC carrega os alelos de risco HLA-DQ2.5 ou HLA-DQ8, responsáveis em codificar as proteínas DQ2 e DQ8, e que representam 35% do risco hereditário da doença DC. Até o momento, apenas alguns fatores genéticos foram especificamente ligados às DCR I ou II. Pacientes com DCR são mais propensos a serem homozigotos para HLA-DQ2.5, em comparação àqueles com DC [6].
Na DCR há uma expressão incontrolada da IL-15, perpetuando a ativação dos linfócitos intraepiteliais, resultando na proliferação clonal dos linfócitos T e emissão de sinais anti-apoptóticos. No entanto, o número de células NK na DCR é inferior ao encontrado na DC com DSG e no LTAE. Com base nestas evidências, é provável que bloqueadores da IL-15 ou fármacos que promovam o aumento de células NK possam ser um potencial terapêutico [1,17].
Na DCR, a desnutrição é inerente, no entanto, é significativamente pior na DCR II. A DCR I apresenta má absorção contínua ou recente semelhante à DC clássica não tratada. A refratariedade primária é definida por sintomas persistentes apesar de uma DSG, enquanto a refratariedade secundária é definida por uma resolução inicial de sintomas com uma DSG, mas com recorrência posterior. A diarreia é o sintoma predominante da DCR, embora dor abdominal, perda de peso e sudorese noturna também sejam percebidos. Sintomas menos frequentes incluem: deficiências vitamínicas, anemia, fadiga e doenças autoimunes coexistentes. Hiperesplenismo e hipoalbuminemia também podem ser vislumbrados na DCR, sendo o segundo, mais agravado na DCR II, em função das grandes úlceras oriundas de jejunite ulcerativa, também causadoras de diarreia crônica grave e enteropatia por perda proteica [8,2].
O diagnóstico de DC ainda é um ponto controverso, vez que pode se apresentar com diferentes e diversos delineamentos, mas, em suma, é baseado em um conjunto de achados clínicos, histopatológicos anormais do intestino delgado e detecção de autoanticorpos circulantes associados a doença [6,19].
A investigação da DC com testes sorológicos e biópsia deve anteceder a introdução do tratamento, quando o paciente está em uma dieta contendo glúten, para evitar resultados falso-negativos. Os testes sorológicos são: (i) Anticorpo anti-endomísio, IgA, que detecta anticorpos contra a camada de tecido conjuntivo que cobre a camada muscular do intestino; (ii) anti-transglutaminase tecidual (Anti-tTG e Anti-tTG IgA), testes altamente específicos e sensíveis, preferenciais para a detecção de DC em maiores de 2 anos e (iii) anti-gliadina deaminada (Anti-DGP IgG), teste a ser combinado com o Anti-tTG IgA para detecção de DC em menores de 2 anos [19].
Idealmente, o diagnóstico deve se dar pela combinação da positividade de testes sorológicos e de biópsia duodenal com alterações típicas (atrofia das vilosidades e aumento na quantidade de linfócitos intraepiteliais (LIEs)) [1,2].
A primeira etapa diagnóstica consiste na detecção de IgG anti-TG2. Se a sorologia for positiva, biópsias duodenais são necessárias para confirmar o diagnóstico. Ademais, recomenda-se o acompanhamento anual por biópsia até a recuperação completa das vilosidades, mesmo em pacientes assintomáticos, vez que a atrofia das vilosidades pode persistir por um longo período (6 meses a 5 anos) em mais de 40% dos pacientes em DSG, e a falta de cicatrização da mucosa tem sido associada ao aumento do risco de complicações, notadamente fraturas ósseas e linfomas. A atrofia persistente das vilosidades intestinais deve induzir a verificação sobre a adesão à DSG e, em caso de adesão estrita, a excluir a DCR [2].
Em contraste com a DC, a DCR é quase sempre sintomática e suspeita-se do diagnóstico devido aos sintomas persistentes e à falta de recuperação histológica após a DSG. A classificação atual da DCR não integra totalmente seu espectro de características clínicas, histopatológicas e imunofenotípicas. Os sintomas gastrointestinais são o único critério clínico de DCR e, embora a maioria dos pacientes com DCR apresente atrofia vilosa grave na biópsia do intestino delgado, um subconjunto pode apresentar atrofia vilosa leve ou ausente [18].
A apresentação da DCR I é menos grave e geralmente imita a DC ativa. As úlceras jejunais são ausentes ou muito pequenas. Ao revelar grandes úlceras, a cápsula endoscópica pode ajudar a diferenciar DCR I e DCR II. O diagnóstico de DCR I requer sorologia celíaca negativa e confirmação de adesão estrita à DSG por um nutricionista. Recentemente, novos testes de urina e fezes, que permitem a detecção quantitativa de peptídeos imunogênicos de gliadina logo após a ingestão de glúten, podem ser usados para avaliar a adesão à dieta. O diagnóstico de DCR II é mais codificado, pois é baseado na demonstração de uma população clonal de LIEs com um fenótipo distinto [2].
Diversas causas de falta de resposta à DSG devem ser excluídas antes de um diagnóstico de DCR (Figura 2). Em destaque, as investigações que podem ser planejadas durante a consulta inicial de acompanhamento em suspeita de DCNR, para agilizar a identificação e diagnóstico de DCR. Onde houver preocupação clínica clara de ingestão contínua de glúten, uma revisão dietética no início da via de investigação pode evitar exames desnecessários [20,12].
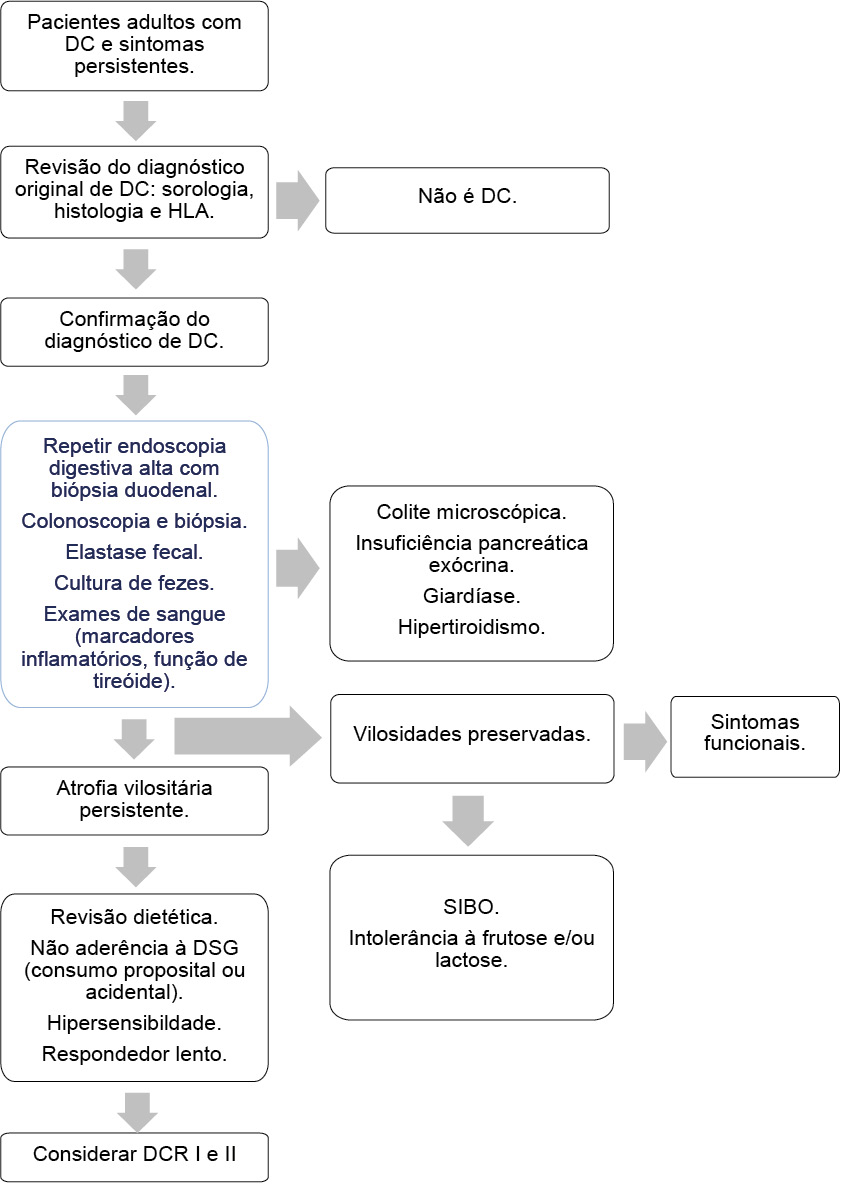
Fonte: Adaptado e traduzido [20]. DC: doença celíaca; HLA: antígenos leucocitários humanos; DSG: dieta sem glúten; SIBO: supercrescimento bacteriano do intestino delgado; DCR I: doença celíaca refratária tipo I; DCR II: doença celíaca refratária tipo II.
Figura 2 – Algoritmo para investigação de pacientes celíacos com sintomas persistentes
Uma vez descartadas ou efetivamente tratadas as causas potenciais de não responsividade à DSG, e desde que as biópsias mostrem atrofia vilosa significativa e criptas, a DCR pode ser considerada. O passo seguinte envolve categorização de DCR com base no fenótipo de LIEs para prognóstico. Isso pode ser feito pela avaliação de ambos os testes de imuno-histoquímica e rearranjo gênico TCR (PCR) ou apenas a citometria de fluxo (exame padrão ouro para avaliação de casos de DCR) [12]. A DCR II é definida por avaliação endoscópica que revela enteropatia, uma população de linfócitos intra-epiteliais aberrante e monoclonalidade do receptor do gene da célula T. Embora raros, os pacientes com DCR II têm alto risco de desenvolver LTAE e uma taxa de mortalidade de 50-60% em cinco anos [8,4].
Por fim, pode-se considerar os testes genéticos como ferramenta auxiliar para exclusão do diagnóstico de DC, vez que tal diagnóstico é improvável se HLA-DQ2 e HLA-DQ8 estão ausentes [19].
O tratamento da DC é, comum e essencialmente, dietético, consistindo numa DSG, que costuma também se apresentar como eficaz, levando à diminuição dos anticorpos sorológicos associados à doença, à recuperação da mucosa intestinal e à resolução dos sintomas [4,19]. Entretanto, embora a melhora inicial possa ocorrer, a manutenção da DSG rigorosa pode ser bem desafiadora, pois o glúten também está ocultamente presente em ínumeros produtos comerciais alimentícios e não-alimentícios, como medicamentos e cosméticos. Essa presença ignorada de glúten, inclusive, é a razão mais comum da DCNR, já que os indivíduos com a doença respondem incompletamente à DSG. Esses pacientes podem ser incapazes de tolerar as pequenas quantidades de glúten (menos de 20 ppm) consideradas seguras para a maioria dos pacientes [4,19,13]. A contaminação cruzada inadvertida é difícil de ser afastada e, assim, a ingestão não intencional torna-se inevitável. A adesão a DSG, somada à palatabilidade, às restrições sociais e, por vezes, ao custo, torna-se uma tarefa árdua. Não há atualmente medicamentos que possam prevenir, de forma confiável e segura, os danos causados à mucosa intestinal pela exposição ao glúten. Por todos estes fatores, inclusive, é que se recomenda que a gestão da DSG seja acompanhada por nutricionista [4,19,13].
No caso da DCR, a DSG estrita é igualmente indispensável e o objetivo da terapia nutricional é resolver a desnutrição e prevenir o desenvolvimento de LTAE. Todavia, tal terapia é insuficiente para controlar a doença, por isso são necessários tratamentos complementares com abordagem farmacológica. Pacientes com DCR I respondem bem a uma DSG isenta de contaminação e, embora haja o risco de complicações devido à enteropatia persistente, tendem a ter um curso benigno em comparação aos pacientes com DCR II. Estes são tipicamente mais velhos na apresentação e têm mais sintomas graves, como diarreia e perda de peso. Pacientes com DCR devem ser encaminhados para centros especializados em seu tratamento e devem ser encorajados a tomar suplementos vitamínicos em razão de suas frequentes deficiências nutricionais [12,19].
Os avanços recentes na fisiopatologia da DC e da DCR, somados ao fardo social da abordagem terapêutica alimentar e à difícil otimização da saúde e do bem-estar de boa parte dos pacientes, vêm abrindo possibilidades de terapias direcionadas, cuja eficiência e segurança, entretanto, ainda estão sendo estudadas. Alguns exemplos de tratamentos alternativos para DC e DCNR são (i) neutralização do glúten por glutenases; sequestrantes sintéticos orais de gliadina; sequestrantes biológicos orais (anticorpos); (ii) interrupção do transporte de glúten da mucosa via modulação das tight junctions; (iii) modificação do microbioma por antibióticos e probióticos; (iv) vacina de glúten (Nexvax); (v) nanopartículas de glúten desenvolvidas por Bioengenharia [15,4,2].
No entanto, em relação à DCR, devido à sua baixa prevalência e ao mau prognóstico de DCR II, as intervenções terapêuticas, em geral, são baseadas em pequenas séries de casos ou estudos prospectivos abertos com amostras pequenas [15].
Os corticosteróides são usados como tratamento inicial para ambos os tipos de DCR. A melhora subjetiva (sintomática) é comum, mas a extensão da resposta da mucosa não é clara [4].
A azatioprina, usada no tratamento quimioterápico, é um dos análogos de nucleosídeos estudados como tratamento alternativo à DCR. Combinada com esteróides, os primeiros estudos mostraram respostas subjetivas e histológicas promissoras em DCR, mas uma tendência preocupante de progressão crescente para LTAE em DCR II [15,4,9].
O transplante de células tronco hemopoéticas (TCTH) é uma modalidade terapêutica baseada na utilização de imunoablação seguida de reinfusão de células progenitoras hematopoiéticas para regenerar linfócitos T virgens. Dado que uma alta proporção de pacientes com DCR II progride para LTAE, vale a pena considerar a possibilidade de mais terapias radicais. O auto-TCTH parece seguro e tem sido usado com sucesso nesse cenário, podendo resultar em remissão clínica de longo prazo com melhor qualidade de vida em pacientes com DCR II [21,9].
Conclusão
A DCR é uma doença complexa, de etiologia multifatorial e fisiopatologia baseada na imunidade e predisposição genética, caracterizada em dois tipos (tipo I e tipo II) com características imunofenotípicas distintas. A desnutrição se destaca como sintoma crônico. O diagnóstico é de difícil investigação, vez que a doença confunde-se com outros transtornos gastrointestinais, além de poder apresentar também sintomatologia extraintestinal. O diagnóstico da DCR deve ser feito seguindo critérios bem minuciosos de análise e, para esse rigor, ainda é necessário o desenvolvimento de melhores ferramentas diagnósticas.
O tratamento está em cenário igualmente desfavorável, já que os dados são limitados em quantidade e qualidade. É imprescindível que tais referências sejam revistas no contexto de sua sensibilidade e especificidade para a diferenciação entre os subtipos de DCR e consequente melhor manejo da doença.
O fato da DCR apresentar patogênese não totalmente esclarecida, terapias adjuvantes têm sido propostas para além do tratamento dietético. Embora promissoras, essas terapias, em sua maioria, apresentaram limitações importantes durante os ensaios clínicos e resultados pouco satisfatórios. Portanto, ainda são necessários mais estudos clínicos com acompanhamento dos pacientes para assegurar resultados mais concretos que tragam, efetivamente, melhora no prognóstico, qualidade e expectativa de vida.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse de qualquer natureza.
Fontes de financiamento
Financiamento próprio.
Contribuição dos autores
Concepção e desenho da pesquisa: RODRIGUES FM, KOBAL PS; Coleta de dados: RODRIGUES FM; Análise e interpretação dos dados: RODRIGUES FM, KOBAL PS, CORREA FF; Redação do manuscrito: RODRIGUES FM, KOBAL PS, CORREA FF; Revisão crítica do manuscrito quanto ao conteúdo intelectual importante: RODRIGUES FM, KOBAL PS, CORREA FF.
Referências
1. Caio G, Volta U, Sapone A, Leffler DA, De Giorgio R, Catassi C, Fasano A. Celiac disease: a comprehensive current review. BMC Med. 2019 Jul;17(1).
2. Malamut G, Cording S, Cerf-Bensussan N. Recent advances in celiac disease and refractory celiac disease. F1000Research. 2019 Jun;8:969.
3. Araújo HM, Araújo WM, Botelho RB, Zandonadi RP. Doença celíaca, hábitos e práticas alimentares e qualidade de vida. Rev Nutr. 2010 Jun;23(3):467-74.
4. Leonard M, Cureton P, Fasano A. Indications and use of the gluten contamination elimination diet for patients with non-responsive celiac disease. Nutrients. 2017 Out;9(10):1129.
5. Wierdsma NJ, Nijeboer P, de van der Schueren MA, Berkenpas M, van Bodegraven AA, Mulder CJ. Refractory celiac disease and EATL patients show severe malnutrition and malabsorption at diagnosis. Clin Nutr. 2016 Jun;35(3):685-91.
6. Soderquist CR, Bhagat G. Cellular and molecular bases of refractory celiac disease. Int Rev Cell Mol Biol. 2021;358:207-240.
7. Malamut G, Cellier C. Refractory celiac disease: epidemiology and clinical manifestations. Dig Dis. 2015;33(2):221-6.
8. Hujoel IA, Murray JA. Refractory celiac disease. Curr Gastroenterol Rep. 2020 Mar;22(4).
9. Woodward J. Improving outcomes of refractory celiac disease – current and emerging treatment strategies. Clin Exp Gastroenterol. 2016 Ago; 9:225-36.
10. De Sousa, LMM, Marques-Vieira, CMA, Severino, SSP, Antunes, AV. A metodologia de revisão integrativa da literatura em enfermagem. RIE. 2017 Nov;21(2):17-26.
11. Page MJ, Moher D, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. PRISMA 2020 explanation and elaboration: updated guidance and exemplars for reporting systematic reviews. BMJ. 2021 Mar:372:n160.
12. Rishi AR, Rubio-Tapia A, Murray JA. Refractory celiac disease. Expert Rev Gastroenterol Amp Hepatol. dez 2015 Dez;10(4):537-46.
13. Taylor AK, Lebwohl B, Snyder CL, Green PHR. Celiac Disease. In: Adam MP, Mirzaa GM, Pagon RA, Wallace SE, Bean LJH, Gripp KW, Amemiya A, editors. GeneReviews® [Internet]. 2019 Jan; 1993-2023.
14. Biesiekierski JR. What is gluten? J Gastroenterol Hepatol. 2017 Fev;32:78-81.
15. Kurada S, Yadav A, Leffler DA. Current and novel therapeutic strategies in celiac disease. Expert Rev Clin Pharmacol. 2016 Jun;9(9):1211-23.
16. Asri N, Rostami-Nejad M, Anderson RP, Rostami K. The gluten gene: unlocking the understanding of gluten sensitivity and intolerance. Appl Clin Genet. 2021 Fev; 14:37-50.
17. Cunha, M, Carneiro, F, Amil, J. Doença celíaca refratária. Arquivos de Medicina. 2013 Fev;27(1):19-26.
18. Soderquist CR, Lewis SK, Gru AA, Vlad G, Williams ES, Hsiao S, Mansukhani MM, Park DC, Bacchi CE, Alobeid B, Green PH, Bhagat G. Immunophenotypic spectrum and genomic landscape of refractory celiac disease type II. Am J Surg Pathol. 2021 Fev;Publish Ahead of Print.
19. Rubio-Tapia A, Hill ID, Kelly CP, Calderwood AH, Murray JA. ACG clinical guidelines: diagnosis and management of celiac disease. Am J Gastroenterol. 2013 Mai;108(5):656-76.
20. Penny HA, Baggus EM, Rej A, Snowden JA, Sanders DS. Non-Responsive coeliac disease: A comprehensive review from the NHS england national centre for refractory coeliac disease. Nutrients. 2020 Jan;12(1):216.
21. Al-toma A. Hematopoietic stem cell transplantation for non-malignant gastrointestinal diseases. World J Gastroenterol. 2014;20(46):17368.