Rogério Eduardo Tavares Frade1, Ana Paula Ribeiro Paiotti1, Sender Jankiel Miszputen1
1Universidade Federal de São Paulo (UNIFESP), São Paulo, SP, Brasil
Recebido em: 17 de abril de 2024; Aceito em: 12 de junho de 2024.
Correspondência: Rogério Eduardo Tavares Frade, rogeriofrade53@gmail.com
Como citar
Frade RET, Paiotti APR, Miszputen SJ. Efeitos do simbiótico (SIMBIOFLORA®) em pacientes com doença de Crohn: um estudo piloto. Nutr Bras. 2024;23(1):734-745. doi:10.62827/nb.v23i1.3005
Resumo
Introdução: A doença inflamatória intestinal é uma denominação genérica que engloba várias entidades patológicas, sendo as mais comuns: retocolite ulcerativa inespecífica e doença de Crohn, que acometem o trato gastrointestinal. Alguns estudos têm sido desenvolvidos a fim de testar a eficácia dos prebióticos, probióticos e simbióticos na melhora do quadro clínico de indivíduos com doença de Crohn, principalmente por ser conhecida a capacidade desses compostos de melhorar a integridade da mucosa intestinal e modular a microbiota e as respostas imunoinflamatórias. Objetivo: Avaliou-se os efeitos do simbiótico sobre a atividade clínica e inflamatória em pacientes com doença de Crohn. Métodos: Trata-se de um estudo intervencional, duplo-cego com participação final de 8 voluntários adultos, de ambos os sexos, com diagnóstico de doença de Crohn em atividade inflamatória. Resultados: Foi possível observar que o uso do simbiótico diário durante o período de 2 meses resultou em melhorias estatisticamente significativas (p < 0,05) em relação a condição inicial (pré – intervenção) em todas as variáveis estudadas. Conclusão: O estudo sugere que o simbiótico pode ter auxiliado na diminuição dos episódios de evacuações liquidas diárias, dor abdominal, melhora na consistência das fezes e na redução dos níveis plasmáticos da proteína C reativa.
Palavras-chave: Doenças inflamatórias intestinais; doença de crohn; microbiota.
Abstract
Introduction: Inflammatory bowel disease is a generic term that encompasses various pathological entities, the most common of which are non-specific ulcerative colitis and Crohn’s disease, which affect the gastrointestinal tract. Some studies have been carried out to test the efficacy of prebiotics, probiotics and synbiotics in improving the clinical condition of individuals with Crohn’s disease, mainly because these compounds are known to improve the integrity of the intestinal mucosa and modulate the microbiota and immune-inflammatory responses. Objective: To evaluate the effects of symbiotics on clinical and inflammatory activity in patients with Crohn’s disease. Methods: This is an interventional, double-blind study with final participation of 8 adult volunteers, of both sexes, diagnosed with Crohn’s disease in inflammatory activity. Results: In the results found It was possible to observe that the use of the daily symbiotic during the period of 2 months resulted in statistically significant improvements (p < 0.05) in relation to the initial condition (pre-intervention) in all the variables studied. Conclusion: The study suggests that the symbiotic may have helped reduce episodes of daily liquid bowel movements, abdominal pain, improved stool consistency and reduced plasma levels of C-reactive protein.
Keywords: Inflammatory bowel diseases; crohn’s disease; microbiota.
Introdução
Várias são as doenças intestinais que se caracterizam por processo inflamatório crônico. Porém, a denominação doença inflamatória intestinal acabou se restringindo à retocolite ulcerativa (RCU) e à doença de Crohn (DC) [1]. Estima-se atualmente que no mundo haja 10 milhões de pessoas com doença inflamatória intestinal [2].
Embora a patogênese da doença inflamatória intestinal (DII) ainda não esteja inteiramente esclarecida, considera-se que o estabelecimento e manutenção da inflamação, em ambas as doenças, resultem da interação entre fatores genéticos e resposta inadequada do sistema imunológico intestinal, inato e adaptativo, quando exposto à microbiota, comensal e/ou patogênica, e agressões do meio exterior – tabagismo, medicamentos e, talvez, antígenos alimentares [11,12].
Evidências sugerem que desequilíbrios na composição da microflora ou da sua relação com o hospedeiro podem estar implicados na origem da atopia doença inflamatória intestinal [13] e da enterocolite necrotizante [14].
As abordagens nutricionais visando a microbiota e o sistema imune estão se tornando cada vez mais promissoras [15] e a modulação da microbiota, através da suplementação de pré, probióticos e simbióticos, podem desempenhar um papel protetor no processo inflamatório e auxiliar na indução e/ou manutenção da remissão na DII [16,17].
Combinações de simbióticos podem ter efeitos positivos na mucosa intestinal. Por isso, a avaliação do papel dos simbióticos como uma forma alternativa de terapia para DII deve ser investigada [18].
Avaliou-se os efeitos do simbiótico simbioflora® x versus placebo sobre a atividade clínica inflamatória em pacientes com doença de Crohn e associar os resultados da intervenção sobre o Peso; Índice de Massa Corporal (IMC); Proteína C reativa (PCR); Índice de Harvey Bradshaw (IHB) e Escala de Bristol.
Métodos
Trata-se de um estudo intervencional, duplo-cego com duração de 120 dias (60 dias de simbiótico e 60 dias de placebo), A seleção se deu exclusivamente aos pacientes atendidos no Ambulatório de Doenças Inflamatórias Intestinais da Disciplina de Gastroenterologia da Escola Paulista de Medicina da Universidade Federal de São Paulo (Unifesp). Foram recrutados 15 participantes adultos, de ambos os gêneros, aqueles que no prontuário constavam com doença de Crohn, e, após serem avaliados pelo médico (confirmação do diagnóstico e índice de atividade inflamatória) receberam informações escritas e verbais sobre o estudo, esclareciam as dúvidas e, concordando, assinavam o termo de consentimento livre e esclarecido, informado por escrito antes de entrar no estudo.
O simbiótico utilizado foi o (SIMBIOFLORA®) e o placebo foi polidextrose, ambos fornecido pela empresa Farmoquímica S/A, São Paulo – Brasil.
O Comitê de Ética aprovou este estudo, sob número 1.856.030. O estudo foi conduzido sob os princípios éticos para pesquisa médica envolvendo participantes humanos da Declaração de Helsinque.
Posologia do simbiótico e placebo
Os participantes foram orientados a utilizar 2 sachês ao dia (1 pela manhã e outro a noite) em jejum, durante o período proposto pelo estudo.
Ao conteúdo de um sachê deveriam ser adicionados 100 ml de água filtrada, em temperatura ambiente e misturados com uma colher até a completa diluição.
OBS: O pesquisador e o participante não sabiam o que estava sendo ofertado. Somente um membro da empresa sabia qual era simbiótico e placebo.
Abaixo o fluxograma do experimento, seguido da descrição das etapas (Figura 1).
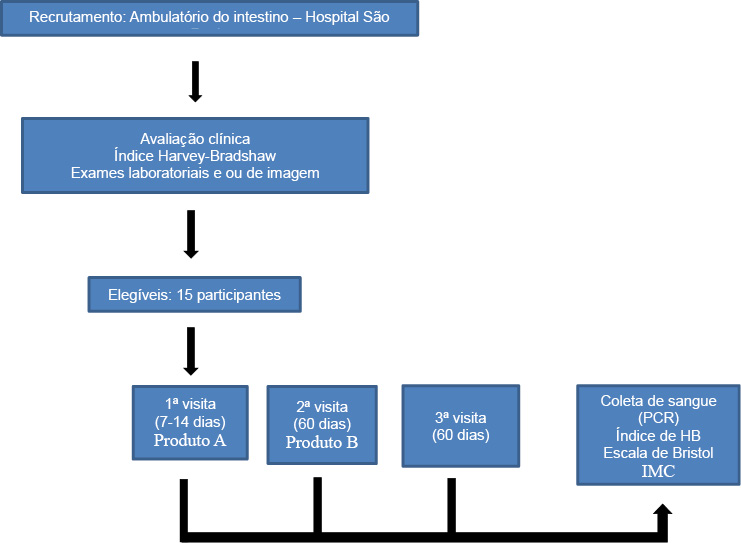
Figura 1 - Fluxograma do experimento
Recrutamento: Os participantes se submetiam à avaliação do médico para confirmação do diagnóstico e da atividade da doença através do Índice de Harvey-Bradshaw, sinais clínicos, exames laboratoriais e/ou de imagem, para inclusão no estudo.
1ª visita (após 7 a 14 dias): Todos os participantes eram encaminhados ao Laboratório Central do Hospital São Paulo onde era realizada a coleta de sangue e a sua análise; posteriormente passavam pela avaliação do médico (para medida do índice de atividade inflamatória pelo IHB) e do pesquisador (nutricionista) para pesagem, cálculo do IMC e aplicação da escala de Bristol; ao final recebiam um kit composto por: 1 sacola plástica, 120 sachês do produto A e orientações por escrito dos procedimentos, etapas do estudo, posologia do produto e telefone de contato do pesquisador.
2ª visita: Sessenta dias após o uso do produto A o participante retornava para realizar todos os procedimentos iguais a primeira visita e receber o kit com o produto B.
3ª visita: Sessenta dias após o uso do produto B o participante retornava para realizar todos os procedimentos iguais as visitas anteriores, encerrando o estudo.
Análise estatística
Os dados foram resumidos em cada avaliação (momentos: Pré, Pós A e Pós B) através da média e desvio padrão para variáveis quantitativas e através do número de casos e percentuais no caso de variáveis qualitativas.
Foi utilizado o teste estatístico ANOVA para variáveis quantitativas com distribuição normal e, para comparação entre os momentos, o teste Tukey. No caso de distribuição não paramétrica foi utilizado o teste Friedman e, para comparação entre os momentos, o Wilcoxon.
Nível de significância foi considerado para valores de p<0,05.
Resultados
Dos 15 participantes inicialmente recrutados, 8 completaram todas as fases do estudo com média de idade 39,75 anos e desvio padrão ±16,32 anos. Sendo 7 mulheres com média de idade 42 anos e desvio padrão ± 21,1 anos e 1 homem de 24 anos.
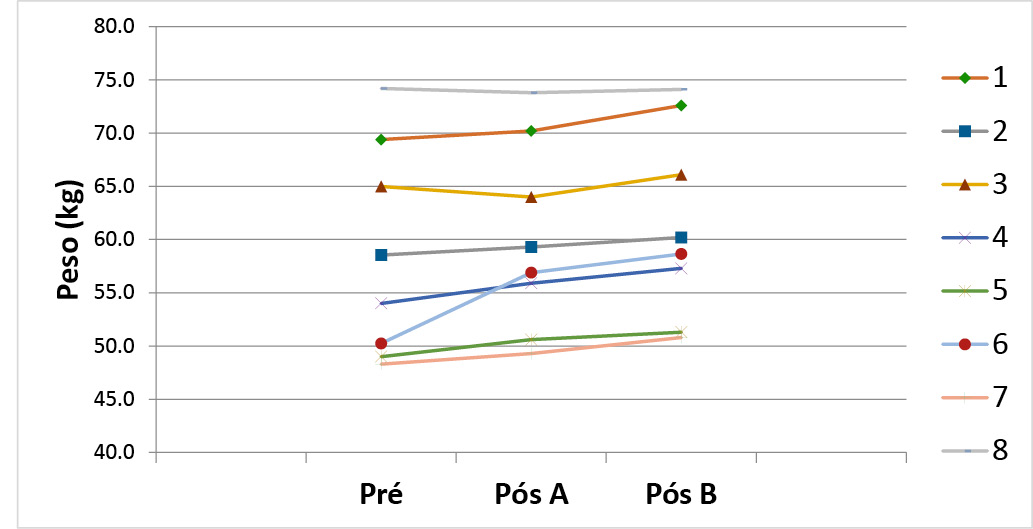
Não houve diferenças entre o peso inicial e após o uso do A (Placebo) (p=0,156); mas tivemos diferenças significativas (com aumento de peso) após o uso do B (Simbiótico) (p=0,004) em relação ao peso inicial (Pré). Já o peso após o uso do A (Placebo) em comparação ao B (Simbiótico), não apresentou diferenças (p= 0,167) (Gráfico 1).
Gráfico 1 - Peso dos pacientes nos momentos Pré, Pós produto A e Pós produto B
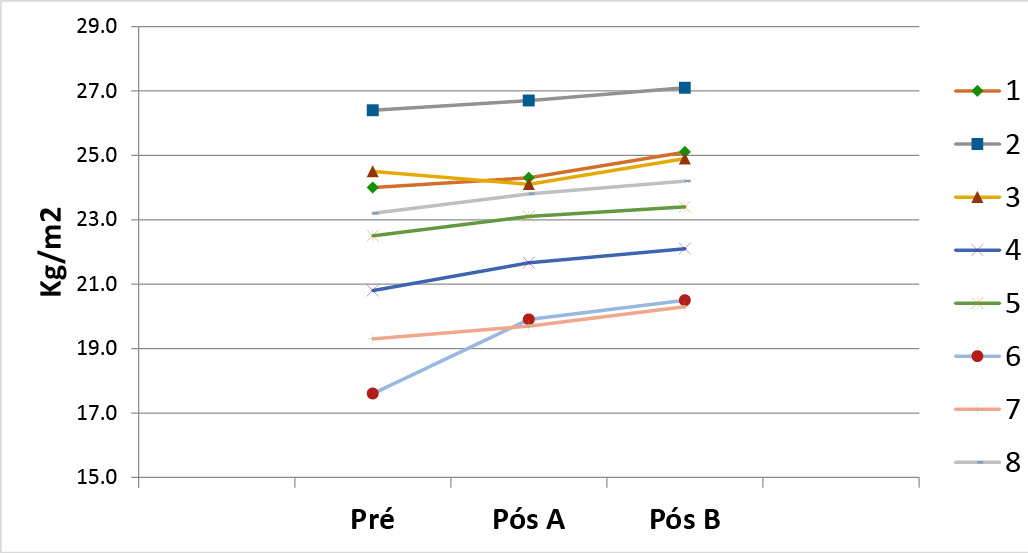
Houve diferenças significativas (com aumento do IMC) entre o inicial (Pré) e após o uso do A (Placebo) (p=0,037) e também após o uso do B (Simbiótico) (p=0,001) em relação ao IMC inicial (Pré). Já após o uso do A (Placebo) em comparação ao B (Simbiótico), não apresentou diferenças (p= 0,071) (Gráfico 2).
Gráfico 2 - IMC dos pacientes nos momentos Pré, Pós produto A e Pós produto B
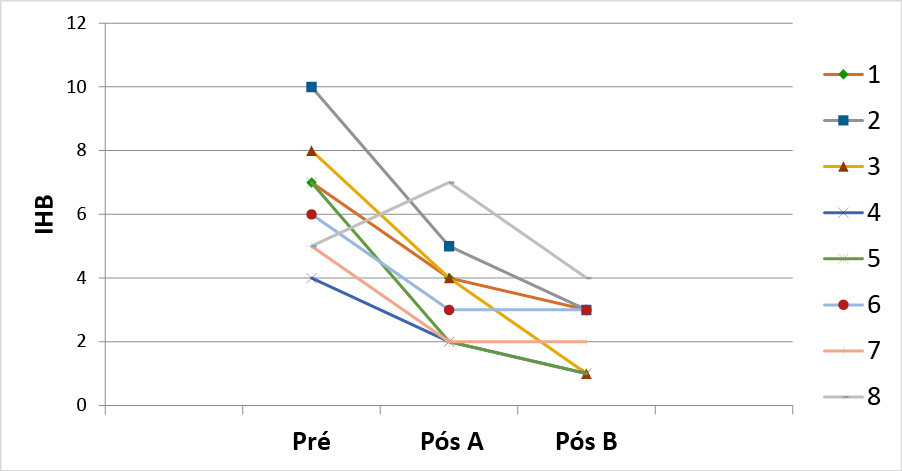
Houve diferenças significativas (com redução do IHB) entre o inicial (Pré) e após o uso do A (Placebo) (p=0,002) e também após o uso do B (Simbiótico) (p=0,001) em relação ao IHB inicial (Pré). Já após o uso do A (Placebo) em comparação ao B (Simbiótico), não apresentou diferenças (p= 0,145) (Gráfico 3).
Gráfico 3 - IHB dos pacientes nos momentos Pré, Pós produto A e Pós produto B
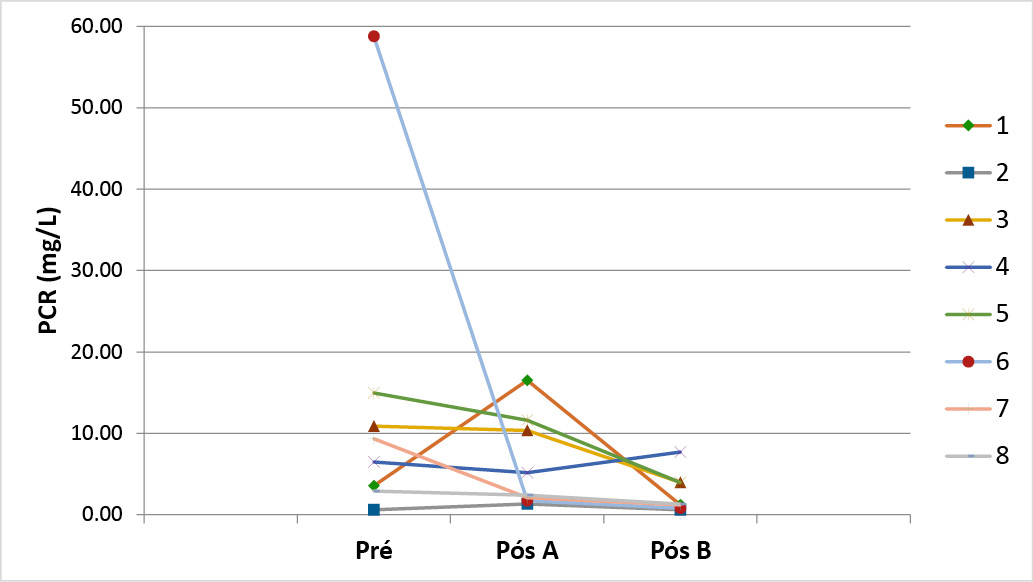
Não houve diferenças entre o PCR após o uso do A (Placebo) (p=0,636); mas tivemos diferenças significativas (com redução do PCR) após o uso do B (Simbiótico) (p=0,032) em relação ao inicial (Pré). Já o PCR após o uso do A (Placebo) em comparação ao B (Simbiótico), não apresentou diferenças (p= 0,167) (Gráfico 4).
Gráfico 4 - Escala de Bristol dos pacientes nos momentos Pré, Pós produto A e Pós produto B
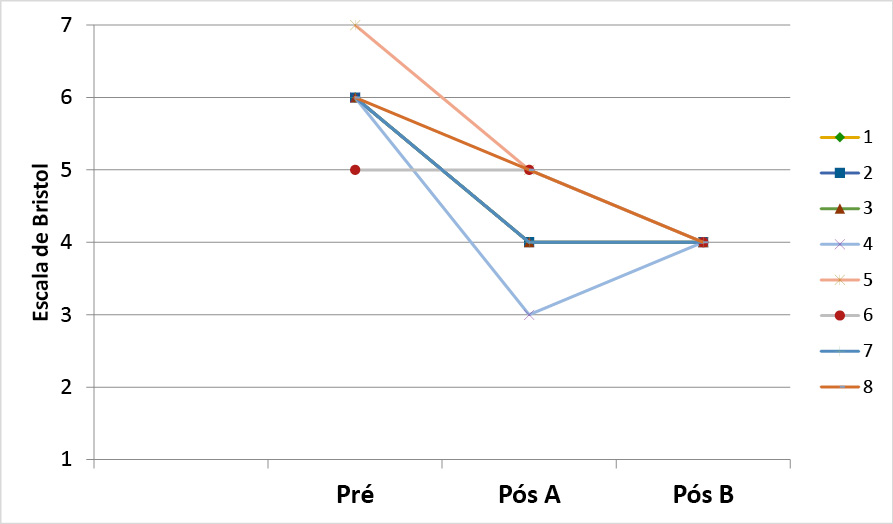
Houve diferenças significativas (com redução da escala de Bristol) entre o inicial (Pré) e após o uso do A (Placebo) (p=0,014) e também após o uso do B (Simbiótico) (p=0,008) em relação a escala de Bristol inicial (Pré). Já após o uso do A (Placebo) em comparação ao B (Simbiótico), não apresentou diferenças (p=0,317) (Gráfico 5).
Gráfico 5 - PCR dos pacientes nos momentos Pré, Pós produto A e Pós produto B
Discussão
A abordagem terapêutica farmacológica disponível para o tratamento da DII tem como função a indução e manutenção da remissão dos sintomas bem como a cicatrização total da mucosa. Contudo, a heterogeneidade dos casos tem desafiado os clínicos quanto ao tipo de tratamento mais adequado. Embora exista vários tratamentos disponíveis, uma boa parcela dos pacientes apresenta falha ou perda de resposta bem como complicações por uso prolongado [19,20]. Nesse sentido, a busca por novas terapias que possam agregar às terapias ora existentes e beneficiar os pacientes se faz necessária [21].
Diante disso, o presente estudo avaliou os efeitos do simbiótico Simbioflora® na atividade clínica e inflamatória em pacientes com DC. Em sua composição, Simbioflora® apresenta quatro cepas probióticas relacionadas a diferentes benefícios à saúde humana como ação anti-inflamatória, antioxidantes e aumento da imunidade [22,23]. Além disso, contém em sua composição FOS, cuja ação prebiótica descrita anteriormente, favorece a proliferação de bifidobactérias que induzem respostas imunorregulatórias [24].
Os resultados do presente estudo demonstraram que o uso diário do simbiótico durante o período de 2 meses resultou em melhorias estatisticamente significativas (p < 0,05) em relação a condição inicial (pré–intervenção) em todas as variáveis estudadas (peso, estado nutricional, índice de atividade clínica e inflamatória). Quanto aos resultados da avaliação do índice de atividade da DC (Harvey-Bradshaw), em suas variáveis (bem-estar geral; dor abdominal e número de evacuações líquidas por dia) observamos a diminuição dos escores de todos os voluntários de ambos os grupos, assim como na soma dos escores do IHB. Fato esse importante, pois, a redução do número de evacuações líquidas diárias e da dor abdominal, indica uma melhora na qualidade de vida do paciente; o que é extremamente relevante para sua rotina diária.
Em um estudo randomizado, duplo-cego e placebo-controlado conduzido por Waitzberg et al. [25], a suplementação dietética com o Simbioflora® em 100 mulheres adultas constipadas diagnosticadas pelos critérios do ROME III, melhorou os parâmetros de evacuação e a intensidade da constipação, com benefícios significativos a partir da segunda semana após a intervenção. Contudo, os autores destacam que não houve diferenças expressivas em relação aos sintomas abdominais (dor abdominal, inchaço e flatulência).
Um dado a ser destacado relaciona-se à dosagem da PCR que mostrou uma redução significativa após o uso do Simbiótico (p=0,032) em relação ao valor encontrado no momento pré-intervenção. Esta proteína é considerada um importante marcador do estado inflamatório. Em uma revisão sistemática e meta-análise feita por Kazemi et al. [26], a suplementação com probióticos/simbióticos diminuiu os níveis séricos de PCR em indivíduos saudáveis e em diferentes condições patológicas, contudo, observou-se maior eficácia nos indivíduos com DII.
Em um estudo similar, Steed et al. [27] observaram melhorias significativas nos resultados clínicos em pacientes que usaram simbiótico por 3 meses; com reduções em ambos os índices de atividade da doença de Crohn e escores histológicos. O simbiótico teve pouco efeito sobre IL-18, INF-γ e IL-1β da mucosa; porém, reduções significativas ocorreram na expressão de TNF-α, além do aumento na proliferação de bifidobactérias na mucosa.
Além da capacidade anti-inflamatória, uma ação anti-infecciosa tem sido atribuída ao uso de simbióticos. Taborda et al. [28] demonstraram que a suplementação com Simbioflora® reduziu a incidência de infecção de ferida operatória em pacientes com câncer colorretal. Seus resultados mostraram que apenas um paciente tratado com o simbiótico apresentou infecção de ferida operatória, enquanto nove casos foram observados no grupo controle. Diferenças significativas em relação a outras complicações infecciosas também foram relatadas, onde três casos de abscesso intra-abdominal e quatro de pneumonia foram diagnosticados no grupo controle, ao mesmo tempo que nenhum foi verificado no grupo que recebeu o simbiótico. O estudo ainda aponta que a ocorrência de eventos como náuseas, vômitos, distensão abdominal, diarreia ou constipação foi igual para ambos os grupos.
No que se refere ao uso do placebo foram observadas diferenças para as variáveis IMC, IHB e escala de Bristol, contudo, acreditamos que o número pequeno de participantes pode ter influenciado na análise estatística. Outro resultado que nos chamou a atenção foi que não houve diferenças entre o peso inicial e após o uso do placebo (p=0,156), mas houve diferença significante com aumento do IMC após o uso do placebo (p=0,037), o que pode estar atrelado ao número limitado de amostras.
Ademais, não foram observadas diferenças significativas entre o uso do simbiótico e placebo, porém, os resultados sugerem uma tendência de redução de valores dos parâmetros analisados após a intervenção com o simbiótico. Nesse sentido, acreditamos que um estudo controlado e randomizado envolvendo um número maior de participantes e métodos de análises mais robustos, se faz necessário para confirmar os resultados.
Inicialmente foram recrutados 15 participantes, porém somente 8 concluíram o protocolo. A baixa adesão dos participantes aos protocolos de pesquisa e as altas taxas de desistência durante o percurso da mesma são situações comumente citadas por outros estudos, as quais possivelmente dificultam a interpretação final dos resultados. Além disso, o uso concomitante de outros medicamentos reguladores da doença também pode influenciar os resultados.
Não podemos esquecer que além do que já foi citado acima, a formulação de melhor preparação probiótica ou simbiótica, a dosagem, duração do seu uso, modo de intervenção e forma de suplementação também podem influenciar os resultados de um ensaio clínico [26,29,30].
Conclusão
Viu-se que o simbiótico pode ter auxiliado na diminuição dos episódios de evacuações liquidas diárias, dor abdominal e melhora na consistência das fezes, interferindo positivamente, na qualidade de vida dos participantes. O simbiótico também pode ter tido efeito na redução dos níveis plasmáticos da proteína C reativa, o que indica uma melhora do quadro inflamatório. Não houve piora do quadro clínico dos participantes que usaram o simbiótico. As abordagens nutricionais visando a microbiota estão se tornando cada vez mais promissoras e a modulação da microbiota, através da suplementação de prebióticos, probióticos e simbióticos podem desempenhar um papel protetor no processo inflamatório e auxiliar na indução e/ou manutenção da remissão nas doenças inflamatórias intestinais.
Agradecimentos
À disciplina de Gastroenterologia da Universidade Federal de São Paulo; à empresa Farmoquímica S/A, São Paulo, Brasil, pelo apoio à pesquisa e a Profa. Gianni M. S. dos Santos pela análise estatística.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse de qualquer natureza.
Fontes de financiamento
Universidade Federal de São Paulo
Contribuição dos autores
Concepção e desenho da pesquisa: FRADE RET; Coleta de dados: FRADE RET; Análise e interpretação dos dados: FRADE RET, PAIOTTI APR, MISZPUTEN SJ; Redação do manuscrito: FRADE RET, PAIOTTI APR, MISZPUTEN SJ ; Revisão crítica do manuscrito quanto ao conteúdo intelectual importante: FRADE RET, PAIOTTI APR, MISZPUTEN SJ.
Referências
1. World Gastroenterology Organisation [Internet]. Probióticos e prebióticos; fev 2017 [citado 23 ago 2021]. Disponível em: https://www.worldgastroenterology.org/UserFiles/file/guidelines/probiotics-and-prebiotics-portuguese-2017.pdf
2. European Federation of Crohn’s & Ulcerative Colitis Associations. World IBD Day 2020 | efcca.org; dez 2019 [citado 13 ago 2020]. Disponível em: https://www.efcca.org/projects/world-ibd-day-2020
3. Hammer T, et al. The Faroese IBD Study: Incidence of Inflammatory Bowel Diseases Across 54 Years of Population-based Data. J Crohns Colitis. 2016 Aug;10(8):934-42. doi: 10.1093/ecco-jcc/jjw050.
4. Gasparini RG, Sassaki LY, Saad-Hossne R. Inflammatory bowel disease epidemiology in São Paulo State, Brazil. Clin Exp Gastroenterol. 2018 Oct 30;11:423-429. doi: 10.2147/CEG.S176583.
5. Selvaratnam S, et al. Epidemiology of inflammatory bowel disease in South America: A systematic review. World J Gastroenterol. 2019 Dec 21;25(47):6866-6875. doi: 10.3748/wjg.v25.i47.6866.
6. Kotze PG, et al. Progression of Inflammatory Bowel Diseases Throughout Latin America and the Caribbean: A Systematic Review. Clin Gastroenterol Hepatol. 2020 Feb;18(2):304-312. doi: 10.1016/j.cgh.2019.06.030.
7. Parente JM, et al. Inflammatory bowel disease in an underdeveloped region of Northeastern Brazil. World J Gastroenterol. 2015 Jan 28;21(4):1197-206. doi: 10.3748/wjg.v21.i4.1197.
8. Quaresma AB, Kaplan GG, Kotze PG. The globalization of inflammatory bowel disease: the incidence and prevalence of inflammatory bowel disease in Brazil. Curr Opin Gastroenterol. 2019 Jul;35(4):259-264. doi: 10.1097/MOG.0000000000000534.
9. Zaltman C, et al. Real-world disease activity and sociodemographic, clinical and treatment characteristics of moderate-to-severe inflammatory bowel disease in Brazil. World J Gastroenterol. 2021 Jan 14;27(2):208-223. doi: 10.3748/wjg.v27.i2.208.
10. Parra RS, et al. Quality of life, work productivity impairment and healthcare resources in inflammatory bowel diseases in Brazil. World J Gastroenterol. 2019 Oct 14;25(38):5862-5882. doi: 10.3748/wjg.v25.i38.5862.
11. Lee SH, Kwon JE, Cho ML. Immunological pathogenesis of inflammatory bowel disease. Intest Res. 2018 Jan;16(1):26-42. doi: 10.5217/ir.2018.16.1.26.
12. Turpin W, Goethel A, Bedrani L, Croitoru Mdcm K. Determinants of IBD Heritability: Genes, Bugs, and More. Inflamm Bowel Dis. 2018 May 18;24(6):1133-1148. doi: 10.1093/ibd/izy085.
13. Fiocchi C. Inflammatory bowel disease pathogenesis: where are we? J Gastroenterol Hepatol. 2015 Mar;30 Suppl 1:12-8. doi: 10.1111/jgh.12751.
14. Murphy K, et al. Probiotics, Prebiotics, and Synbiotics for the Prevention of Necrotizing Enterocolitis. Front Nutr. 2021 Sep 7;8:667188. doi: 10.3389/fnut.2021.667188.
15. Celiberto LS, et al. Inflammatory bowel disease and immunonutrition: novel therapeutic approaches through modulation of diet and the gut microbiome. Immunology. 2018 Sep;155(1):36-52. doi: 10.1111/imm.12939.
16. Saez-Lara MJ, Gomez-Llorente C, Plaza-Diaz J, Gil A. The role of probiotic lactic acid bacteria and bifidobacteria in the prevention and treatment of inflammatory bowel disease and other related diseases: a systematic review of randomized human clinical trials. Biomed Res Int. 2015; 2015:505878. doi: 10.1155/2015/505878.
17. Jia K, Tong X, Wang R, Song X. The clinical effects of probiotics for inflammatory bowel disease: A meta-analysis. Medicine (Baltimore). 2018 Dec;97(51):e13792. doi: 10.1097/MD.0000000000013792.
18. Akutko K, Stawarski A. Probiotics, Prebiotics and Synbiotics in Inflammatory Bowel Diseases. J Clin Med. 2021 Jun 2;10(11):2466. doi: 10.3390/jcm10112466.
19. Harvey RF, Bradshaw MJ. Measuring Crohn’s disease activity. Lancet. 1980 May 24;1(8178):1134-5. doi: 10.1016/s0140-6736(80)91577-9. PMID: 6103463.
20. Bedani R; Rossi E.A. Microbiota intestinal e probióticos: : Implicações sobre o câncer de cólon. J Port Gastrenterol. 2008. Nov; 16(1): 19-28.
21. Ribeiro ARP. A Microbiota Intestinal nas Doenças Inflamatórias do Intestino e o Potencial Recurso a Probióticos e Prebióticos [Internet] [Dissertação]. [Faculdade de Medicina da Universidade de Lisboa]; 2016 [cited 2021 Sep 8]. p. 30. Available from: https://repositorio.ul.pt/bitstream/10451/26038/1/AnaRPRibeiro.pdf
22. Troche JMR, et al. Lactobacillus acidophilus LB: a useful pharmabiotic for the treatment of digestive disorders. Therap Adv Gastroenterol. 2020 Nov 24;13:1756284820971201. doi: 10.1177/1756284820971201.
23. Huang J, et al. Lactobacillus paracasei R3 protects against dextran sulfate sodium (DSS)-induced colitis in mice via regulating Th17/Treg cell balance. J Transl Med. 2021 Aug 18;19(1):356. doi: 10.1186/s12967-021-02943-x.
24. Lindsay JO, et al. Clinical, microbiological, and immunological effects of fructo-oligosaccharide in patients with Crohn’s disease. Gut. 2006 Mar;55(3):348-55. doi: 10.1136/gut.2005.074971.
25. Waitzberg DL, et al. Effect of synbiotic in constipated adult women - a randomized, double-blind, placebo-controlled study of clinical response. Clin Nutr. 2013 Feb;32(1):27-33. doi: 10.1016/j.clnu.2012.08.010.
26. Kazemi A, et al. Effect of probiotic and synbiotic supplementation on inflammatory markers in health and disease status: A systematic review and meta-analysis of clinical trials. Clin Nutr. 2020 Mar;39(3):789-819. doi: 10.1016/j.clnu.2019.04.004.
27. Steed H, et al. Clinical trial: the microbiological and immunological effects of synbiotic consumption - a randomized double-blind placebo-controlled study in active Crohn’s disease. Aliment Pharmacol Ther. 2010 Oct;32(7):872-83. doi: 10.1111/j.1365-2036.2010.04417.x.
28. Taborda A; Tonial ST; Contu PC; Damin DC. A administração perioperatória de simbióticos em pacientes com câncer colorretal reduz a incidência de infecções pós-operatórias: ensaio clínico randomizado duplo-cego. Revista do Colégio Brasileiro de Cirurgiões. Rio de Janeiro. 2017. Dez; 44, (6):567-573. doi: 10.1590/0100-69912017006004.
29. Ghouri YA, et al. Systematic review of randomized controlled trials of probiotics, prebiotics, and synbiotics in inflammatory bowel disease. Clin Exp Gastroenterol. 2014 Dec 9;7:473-87. doi: 10.2147/CEG.S27530.
30. Sivamaruthi BS. A comprehensive review on clinical outcome of probiotic and synbiotic therapy for inflammatory bowel diseases. Asian Pacific Journal of Tropical Biomedicine. 2018 Mar 8: 179-86. doi:10.4103/2221-1691.228000.