Cristina Lourdes Eick Eifert1, Amanda dos Santos Candido1, Jhulie Anne Pinheiro Kemerich1, Hedioneia Maria Foletto Pivetta1
1Universidade Federal de Santa Maria (UFSM), Santa Maria, RS, Brasil
Recebido em: 6 de março de 2025; Aceito em: 11 de março de 2025.
Correspondência: Jhulie Anne Pinheiro Kemerich, jhulie.k@hotmail.com
Como citar
Eifert CLE, Candido AS, Kemerich JAP, Pivetta HMF. Efeitos da fotobiomodulação no tratamento fisioterapêutico da radiodermite em pacientes com câncer de mama. Fisioter Bras. 2025;26(1):1968-1979. doi:10.62827/fb.v26i1.1045
Resumo
Introdução: A radioterapia (RT) é um tratamento amplamente utilizado no combate ao câncer. No entanto, um dos efeitos adversos mais frequentes desse procedimento é a radiodermite (RD), que pode gerar dor, redução da qualidade de vida e até descontinuidade da RT em suas formas mais graves. A fotobiomodulação (FBM) vem se mostrando um recurso terapêutico promissor, capaz de auxiliar no manejo dessa condição oncológica. Objetivo: Avaliou-se o potencial regenerativo do tratamento fisioterapêutico com FBM na dor, grau e gravidade da RD e qualidade de vida em pacientes com câncer de mama. Métodos: Pesquisa quantitativa quase-experimental com 9 pacientes com câncer de mama que desenvolveram RD após radioterapia. O protocolo de FBM utilizou cluster com LED vermelho (658 nm), LED infravermelho (858 nm) e laser vermelho (660 nm), irradiados simultaneamente, com densidade de energia de 4 J/cm². Foram aplicados perpendicularmente nas áreas afetadas, duas vezes por semana durante 3 semanas, totalizando 6 sessões. A dor foi avaliada pela Escala de Classificação Numérica da Dor (Pain Numeric Rating Scale) - NRS; a RD pelas escalas Critério de Score para Morbidade Aguda por Radiação – RTOG (Radiation Therapy Oncology Group) e Escala de Avaliação de Reação Cutânea Induzida por Radioterapia – RISRAS. A qualidade de vida dermatológica foi avaliada pelo questionário Skindex-16. Resultados: O protocolo fisioterapêutico instituído demonstrou uma melhora significativa com redução da dor (p = 0,018), do grau (p = 0,046) e da gravidade da RD (p = 0,028), além de aumento na qualidade de vida dermatológica (p = 0,038). Conclusão: A FBM demonstrou ser uma estratégia promissora para tratar a RD, promovendo regeneração tecidual e alívio de sintomas. Contudo, estudos adicionais com maior número de participantes são necessários para validar os resultados obtidos.
Palavras-chave: Radiodermite; Terapia com Luz de Baixa Intensidade; Neoplasias da Mama.
Abstract
Introduction: Radiotherapy (RT) is a widely utilized treatment in cancer management. However, one of the most frequent adverse effects of this procedure is radiodermatitis (RD), which can result in pain, reduced quality of life, and, in severe cases, discontinuation of RT. Photobiomodulation (PBM) has emerged as a promising therapeutic approach capable of aiding in the management of this oncological condition. Objective: To evaluate the regenerative potential of physiotherapeutic treatment with PBM regarding pain, degree and severity of radiodermatitis, and quality of life in patients with breast cancer. Methods: A quasi-experimental quantitative study involving 9 breast cancer patients with RD following radiotherapy. The PBM protocol employed a cluster device with red LED (658 nm), infrared LED (858 nm), and red laser (660 nm), simultaneously irradiated with an energy density of 4 J/cm². The devices were applied perpendicularly to the affected areas twice a week for 3 weeks, totaling 6 sessions. Pain was assessed using the Numeric Pain Rating Scale (NRS), RD was evaluated using the Radiation Therapy Oncology Group (RTOG) acute morbidity scoring criteria and the Radiation-Induced Skin Reaction Assessment Scale (RISRAS), and dermatological quality of life was measured using the Skindex-16 questionnaire. Results: There was a significant improvement with a reduction in pain (p = 0.018), degree (p = 0.046) and severity of radiodermatitis (p = 0.028), in addition to an increase in dermatological quality of life (p = 0.038). Conclusion: FBM demonstrated to be a promising strategy to treat radiodermatitis, promoting tissue regeneration and symptom relief. However, additional studies with a larger number of participants are necessary to validate the results obtained.
Keywords: Radiodermatitis; Low-Level Light Therapy; Breast Neoplasms.
Introdução
De acordo com o INCA, são esperados cerca de 704 mil novos casos de câncer (CA) a cada ano até 2025. Dentre esses, o CA de mama é o mais incidente em mulheres de todas as regiões do Brasil, sendo estimados 74 mil novos casos a cada ano até 2025 [1]. A radioterapia (RT) é uma modalidade de tratamento muito frequente, tendo como objetivo principal o controle e erradicação local de tumores. No entanto, ainda há grande ocorrência de efeitos colaterais, como a radiodermite (RD). Atualmente, estudam-se diversos métodos para prevenir e tratar a ocorrência destas complicações, entretanto ainda não há consenso sobre o tratamento mais adequado para a toxicidade induzida pela radiação [2].
A RD é definida como uma reação cutânea por exposição à radiação ionizante advinda da RT, acometendo cerca de 95% dos pacientes, devido à alta sensibilidade da pele à radiação [3,4]. Sua exacerbação pode levar à limitação da dose terapêutica de radiação, causar atraso na conclusão ou até interrupção da RT, o que impacta negativamente no sucesso do tratamento oncológico [5]. Outros possíveis efeitos danosos envolvem alterações estéticas, desconforto, dor e redução da qualidade de vida do paciente [3].
A fotobiomodulação (FBM) é uma terapia baseada no uso da luz, caracterizada por efeitos não térmicos, fotofísicos e fotoquímicos que são responsáveis por promover alterações fisiológicas nas células ou tecidos alvo. Essa técnica utiliza luz vermelha visível ou infravermelho próximo, de baixa intensidade, emitida por diodos laser ou diodos emissores de luz (LEDs). Entre suas principais aplicações se encontram a aceleração do processo de cicatrização, a redução da inflamação e o alívio da dor [4]. Estudos já demonstraram que a FBM se mostrou eficaz na prevenção e manejo da RD em pacientes oncológicos, sendo uma intervenção bem tolerada que reduz a dor e a incidência de reações cutâneas. No entanto, por ser um recurso recentemente utilizado, não há protocolos estabelecidos para o uso de FBM na RD, além de haver grande variância de parâmetros nos estudos [5-9].
Investigou-se os efeitos de um protocolo de tratamento fisioterapêutico com FBM, nos comprimentos de onda vermelho e infravermelho, na RD em pacientes com câncer de mama, analisando seus impactos na dor, cicatrização e na qualidade de vida dermatológica dos pacientes afetados pela RD.
Métodos
Estudo quantitativo quase-experimental com coletas realizadas no período de outubro de 2023 a outubro de 2024, com pacientes com diagnóstico de CA de mama. As voluntárias foram recrutadas através da lista de pacientes assistidos pelo setor de radioterapia e do ambulatório de fisioterapia do Hospital Universitário de Santa Maria (HUSM), com contato realizado imediatamente após o término das sessões de RT. Constatado o desenvolvimento de RD, o paciente foi convidado a participar do estudo e, mediante aceite, agendado horário para avaliação, iniciando-se o atendimento em até 48h após o término da RT. Todos os pacientes assinaram o Termo de Consentimento Livre e Esclarecido e o estudo foi aprovado pelo comitê de ética e pesquisa da instituição sob o nº CAAE: 48881321.4.0000.5346.
Critérios de elegibilidade
Os critérios de inclusão abrangeram pacientes acometidos pelo câncer de mama e que passaram por sessões de RT, tendo desenvolvido RD em qualquer grau em até 48h após o término das sessões. Os critérios de exclusão foram pacientes menores de 18 anos, que apresentavam metástase na pele da região da mama, presença de infecção na região a ser tratada, história de doenças de pele ou autoimunes, história de fotossensibilidade ou incapacidade de responder questionários.
Protocolo de intervenção
O protocolo de tratamento com FBM foi realizado com o aparelho Endophoton - KLD - Brasil, validado e autorizado pela Agência Nacional de Vigilância Sanitária (ANVISA) para uso medicinal. A aplicação da FBM ocorreu 2 vezes na semana, durante 3 semanas [5], totalizando 6 sessões, nas regiões acometidas pela RD, com distância de 1 cm entre os pontos de aplicação. A extremidade do aparelho se manteve a uma distância de cerca de 0,5 cm da pele.
O cluster de irradiação da luz utilizado possui quatro pontos de LED vermelho, quatro de LED infravermelho e um ponto central de laser vermelho. A dosimetria utilizada foi 4 J/cm² por ponto de aplicação [6,9]. As especificações do dispositivo e parâmetros utilizados estão descritas na Tabela 1.
Tabela 1 - Características do dispositivo e parâmetros de irradiação
|
Modelo do aparelho |
Endophoton – KLD – Brasil Número de série FB5GUD11 |
|
Tipo e número de diodos |
1 ponto de laser vermelho 4 pontos de LED vermelho 4 pontos de LED infravermelho |
|
Comprimento de onda (nm) Laser vermelho LED vermelho LED infravermelho |
660 658 858 |
|
Potência (mW) Total Laser vermelho LED vermelho LED infravermelho |
410 50 4x 40 4x 50 |
|
Área do cluster (cm²) Área de cada diodo (cm²) |
7,85 0,035 |
|
Energia (J) Total Laser vermelho LED vermelho LED infravermelho |
32,8 4 4x 3,2 4x 4 |
|
Densidade de energia (J/cm²) Densidade de potência (W/cm²) |
4,18 0,05 |
|
Tempo de irradiação (s) |
80 |
|
Técnica de aplicação |
Pontual |
LED: diodo emissor de luz
Avaliações
As avaliações foram realizadas antes do início do protocolo, após a 3ª sessão e imediatamente ao final da sexta sessão. Os dados sociodemográficos, de comorbidades e do tratamento oncológico foram coletados através de uma versão adaptada do Questionário Sociodemográfico e de Tratamento Oncológico [10].
A avaliação da dor se deu pela Escala de Classificação Numérica da Dor (Pain Numeric Rating Scale) - NRS. Esta escala é utilizada para avaliar a intensidade da dor no momento do questionamento, em uma escala de 0 a 10, onde o zero significa “sem dor” e 10 significa “a pior dor imaginável” [11].
A análise das características da pele e a classificação da gravidade da RD foram realizadas através do Critério de Score para Morbidade Aguda por Radiação – RTOG (Radiation Therapy Oncology Group) e a Escala de Avaliação de Reação Cutânea Induzida por Radioterapia - RISRAS. A RTOG é classificada desde o grau 0 (sem reação), 1 (eritema leve, descamação seca, epilação, sudorese diminuída), 2 (eritema moderado, brilhante, dermatite exsudativa em placas e edema moderado), 3 (dermatite exsudativa além das pregas cutâneas, edema intenso) e 4 (ulceração, hemorragia ou necrose) [12]. A Escala de Avaliação de Reação Cutânea Induzida por Radioterapia (Radiation Induced Skin Reaction Assessment Scale) – RISRAS, analisa os sinais de comprometimento observáveis na pele, tais como eritema, descamação seca, descamação úmida e necrose, com uma pontuação específica de acordo com a sua gravidade ou porcentagem da área acometida, podendo variar entre 0 (pele normal) até 5 (reação mais grave possível). Ademais, conta com uma escala de sintomas do paciente com 5 perguntas para descrever a intensidade das reações cutâneas, variando de 1 (nem um pouco), até 4 (muito). As duas pontuações das escalas de sinais e sintomas são somadas para produzir a pontuação total da reação cutânea, com pontuação total de 36 pontos [12,13].
A avaliação da qualidade de vida foi realizada através do questionário de vida dermatológica específica - Skindex-16. Esse questionário é composto por 16 itens que avaliam os efeitos das doenças da pele na qualidade de vida. Os itens são distribuídos em três domínios: sintomas, emoções, e funcionamento, e são respondidos em uma escala que varia de 0 (nunca se incomodou) até 6 (sempre incomodado), que representa a frequência com que o problema de pele incomodou na última semana. A pontuação é convertida em uma pontuação de 0 a 100, em que quanto mais alta a numeração, pior a qualidade de vida do paciente [14].
Análise de dados
A análise dos dados sociodemográficos foi realizada através da estatística descritiva simples e os dados representados por média, desvio padrão e porcentagem. A média foi empregada para determinar a tendência central dos dados, enquanto o desvio padrão indicou a 18 dispersão dos valores. A porcentagem foi utilizada para expressar a representatividade de categorias específicas em relação ao total, permitindo comparações diretas entre o grupo. Para análise estatística, os dados foram considerados com distribuição não paramétrica pelo teste de Shapiro-Wilk. Assim, a comparação entre o pré e pós-intervenção foi realizada pelo teste de Wilcoxon. Considerou-se diferença significativa um valor de p < 0,05.
Resultados
A amostra do estudo foi constituída por 9 indivíduos do sexo feminino com diagnóstico de CA de mama. Foi excluída do estudo uma paciente por ultrapassar o tempo de 48h após o término da RT. Houve uma perda amostral de três pacientes por motivo de desistência da participação na pesquisa, por dificuldade de acesso ao local de coletas e por desejo do paciente de interromper o tratamento. A inclusão de participantes se deu conforme fluxograma apresentado na Figura 1.
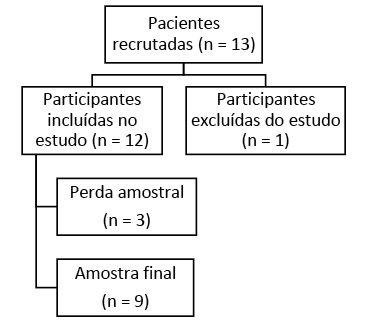
Figura 1 - Fluxograma de seleção das participantes
A média de idade foi de 48 anos, com índice de massa corporal (IMC) médio de 28,7 ± 6,0 kg/m², evidenciando a prevalência de sobrepeso na amostra. Ao início do tratamento, 6 (66,6%) pacientes tinham RD grau 1, e 3 (33,3%) RD grau 2 classificados pela escala RTOG. A maior parte da amostra foi composta por participantes de etnia branca (77,7%). Os dados sociodemográficos estão apresentados na Tabela 2, assim como os dados de tratamento oncológico na Tabela 3.
Tabela 2 - Dados Sociodemográficos da Amostra
|
Variáveis |
Média±DP |
|
Idade IMC Tamanho do busto (cm) |
48,0±12,0 28,7±6,0 101,78±12,44 |
|
n (%) |
|
|
Cor/etnia Branca Preta Parda |
7 (77,7) 1 (11,1) 1 (11,1) |
|
Escolaridade Ensino fundamental incompleto Ensino médio completo Ensino superior incompleto Ensino superior completo |
1 (11,1) 6 (66,6) 1 (11,1) 1 (11,1) |
|
Situação conjugal Casada Solteira |
4 (44,4) 5 (55,5) |
|
Tabagismo Etilismo |
1 (11,1) 0 (0) |
|
Comorbidades Hipertensão arterial sistêmica Doenças da tireoide Sobrepreso Obesidade |
4 (44,4) 3 (33,3) 4 (44,4) 3 (33,3) |
Tabela 3 - Dados do tratamento oncológico
|
Variáveis |
n (%) |
|
Cirurgia Quimioterapia Neoadjuvante Adjuvante Não realizaram quimioterapia Hormonioterapia Radioterapia Dose de radiação (Gy) 40,05 Gy 48,06 Gy Número de sessões 15 18 |
9 (100) 7 (77,7) 4 (44,4) 3 (33,3) 2 (22,2) 7 (77,7) 9 (100) 5 (55,5) 4 (44,4) 5 (55,5) 4 (44,4) |
Os dados das avaliações quanto à dor, grau, gravidade da RD e qualidade de vida relacionada à pele, pré-intervenção, após a 3ª sessão e ao término do protocolo (após 3 semanas) estão apresentados na tabela 4. Os valores de p são referentes à comparação entre a primeira e a última sessão.
Tabela 4 - Dados da avaliação pré, durante e pós-intervenção
|
Variáveis |
Pré (média±DP) |
3ª sessão (média±DP) |
Pós (média±DP) |
p |
|
NRS RTOG RISRAS Skindex-16 |
3,67±2,60 1,33±0,50 8,11±4,90 31,67±17,26 |
4,44±3,09 1,11±0,33 7,33±5,39 28,78±27,14 |
1,33±1,94 0,89±0,33 4,44±3,21 17±26,58 |
0,018* 0,046* 0,028* 0,038* |
*p < 0,05. Classificação Numérica da Dor (Pain Numeric Rating Scale) – NRS, Critério de Score para Morbidade Aguda por Radiação – RTOG (Radiation Therapy Oncology Group), Escala de Avaliação de Reação Cutânea Induzida por Radioterapia (Radiation-Induced Skin Reaction Assessment Scale) – RISRAS
Acerca dos desfechos avaliados, nota-se que houve uma diferença significativa ao final do protocolo de tratamento tanto na dor, avaliada pela escala NRS (p = 0,018), no grau de RD avaliado pela escala RTOG (p = 0,046), na gravidade da RD avaliada pela escala RISRAS (p = 0,028) e na qualidade de vida, medida pela escala Skindex-16 (p = 0,038).
A avaliação da dor antes da aplicação da FBM indicou um nível moderado de dor no pré-tratamento. Após a terceira sessão, houve aumento deste percentual, sugerindo um pico em relação ao início. Contudo, após a última sessão, o escore reduziu significativamente (p = 0,018) evidenciando uma redução comparada às avaliações anteriores e uma melhora no alívio da dor.
A avaliação pela escala RTOG evidenciou uma toxicidade leve no início do tratamento. No pós-tratamento constatou-se uma redução significativa (p = 0,046), demonstrando uma diminuição da toxicidade ao final do protocolo.
A escala RISRAS indicou uma presença moderada de reações cutâneas ao início do tratamento, seguido de leve redução após a terceira sessão. Ao final, houve redução significativa da pontuação (p = 0,028), caracterizando recuperação importante da pele.
Em relação à qualidade de vida dermatológica, avaliada pela escala Skindex-16, a avaliação inicial representou um impacto na qualidade de vida de moderado. Ao final do tratamento, houve redução significativa da pontuação (p = 0,038), demonstrando uma melhora no impacto dermatológico sobre a qualidade de vida dos indivíduos avaliados.
Discussão
Este estudo teve como objetivo avaliar os efeitos da FBM no tratamento fisioterapêutico da RD em pacientes com CA de mama. Foram realizadas avaliação da dor, severidade da RD e qualidade de vida relacionada à pele, pré e pós-intervenção. Observou-se que, ao final do tratamento, todos os desfechos estudados apresentaram melhora significativa, evidenciando que a FBM pode ser uma alternativa segura e eficaz para o tratamento da RD em pacientes oncológicos acometidos por RD.
Assim como os resultados obtidos em nosso estudo, uma revisão sistemática realizada por Aguiar e colaboradores [15] a aplicação da FBM se mostrou uma alternativa promissora na promoção do alívio da dor, corroborando os resultados obtidos neste estudo. Zhang et al. [16] aponta que através da FBM, os fótons são absorvidos por estruturas fotorreceptoras como a citocromo-C-oxidase (CCO) nas mitocôndrias. Esse processo estimula alterações químicas intracelulares, desencadeando respostas neuroprotetoras, com o aumento da produção de moléculas anti-inflamatórias, aumento do fluxo sanguíneo, neurogênese e redução de fatores inflamatórios e estresse oxidativo, consequentemente reduzindo a dor.
O protocolo instituído no presente estudo reduziu a gravidade da RD após 3 semanas de intervenção com aplicação da FBM. De forma semelhante, Hali et al. [17] conduziu um estudo prospectivo que também utilizou os comprimentos de onda vermelho e infravermelho duas vezes por semana, em 20 pacientes com RD, e dentre estes, 15 com CA de mama. Do total de pacientes, 17 iniciaram o tratamento após terminar a RT. Foi observado melhora ao longo das sessões, em que os participantes com grau 1 apresentaram regressão do eritema e clareamento da pele após uma média de três sessões. Ainda, naqueles com grau 2, a melhora das lesões foi observada após uma média de seis sessões. Estes resultados corroboram com os achados no presente estudo, que evidenciaram melhora no grau de RD após 3 semanas.
O protocolo de FBM com LED vermelho e infravermelho pode impactar positivamente a qualidade de vida. Estudos recentes indicam que a FBM é responsável por acelerar a reparação tecidual por meio da modulação de processos inflamatórios e da estimulação da microcirculação, promovendo analgesia e uma melhor oxigenação celular [18]. Consequentemente, esses efeitos ocasionam uma maior deposição de colágeno e, por conseguinte, aceleram a cicatrização, causando um menor impacto negativo na qualidade de vida dos pacientes.
Participantes com sobrepeso e com maior volume do busto podem influenciar no desenvolvimento de RD. No estudo de Cavalcante et al. [19], foi demonstrado que um maior IMC está relacionado ao risco de desenvolver graus mais elevados de RD em pacientes com CA de mama. Isso se dá, pois, indivíduos com IMC mais elevado geralmente têm mamas maiores e o tecido extra interfere na absorção da radiação devido à distribuição não homogênea da dose. No estudo de Vieira et al. [20] que analisou a incidência, gravidade e fatores de risco associados para o desenvolvimento de RD, 71,15% das mulheres tinham sobrepeso ou obesidade e 58% tinham mamas volumosas (circunferência da mama maior que 98 cm). Houve maior incidência de eritema, descamação seca e descamação úmida nessas pacientes, além de maiores graus de RD em pacientes com mamas volumosas. Assim, o presente estudo reforça as evidências já presentes na literatura, de que um maior IMC e mamas maiores são fatores preditivos para o desenvolvimento de RD.
A quimioterapia causa maior fragilidade da pele, também interferindo na incidência de RD. Anoop et al. [21] avaliaram a incidência de toxicidades cutâneas em pacientes com CA de mama que realizaram quimioterapia, evidenciando que 92% das pacientes apresentaram toxicidade cutânea com xerose generalizada e 88% hiperpigmentação da pele. Em relação à radioterapia, sabe-se que o equilíbrio da pele da região alvo do tratamento sofre alterações desde o início. Com o acúmulo de doses através das sessões o desequilíbrio da pele aumenta e favorece o surgimento de alterações como eritema, descamação, hiperpigmentação e prurido, caracterizando a RD [22]. Além disso, a dose de RT pode trazer fragilidade cutânea, aumentando a probabilidade de desenvolver RD. O estudo de McDermott [23] aponta que o fracionamento convencional (2,00 Gy×25) leva a uma dose biologicamente equivalente mais alta para eritema e descamação úmida na superfície da mama do que o hipofracionamento (2,66 Gy×16). No presente estudo, todas as pacientes receberam o hipofracionamento, ainda assim desenvolvendo RD.
Este estudo apresentou algumas limitações, incluindo o tamanho amostral reduzido, devido à dificuldade no recrutamento de pacientes. Além disso, não foi possível incluir um grupo controle, realizar a randomização e o cegamento tanto da amostra quanto dos avaliadores, em função das dificuldades encontradas durante o recrutamento dessa população.
Conclusão
Verificou-se que tanto a dor, severidade da RD e qualidade de vida dermatológica em pacientes com CA de mama tiveram uma melhora significativa após 3 semanas de tratamento com um protocolo fisioterapêutico de FBM com LED. Foi possível observar também que o sobrepeso, obesidade e IMC elevado eram fatores comuns na maioria da amostra, o que pode influenciar na incidência de RD nestas pacientes. Assim, a FBM nos comprimentos de onda vermelho e infravermelho foi capaz de atuar positivamente na regeneração da pele em pacientes com RD.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse de qualquer natureza.
Fontes de financiamento
Financiamento próprio.
Contribuição dos autores
Concepção e desenho da pesquisa: Pivetta HMF, Kemerich JAP, Eifert CLE; Obtenção de dados: Eifert CLE, Candido AS; Análise e interpretação dos dados: Eifert CLE, Candido AS, Pivetta HMF; Análise estatística: Pivetta HMF; Redação do manuscrito: Eifert CLE, Candido AS, Pivetta HMF, Kemerich JAP; Revisão crítica do manuscrito quanto ao conteúdo intelectual importante: Pivetta HMF, Kemerich JAP.
Referências
1. Brasil. Ministério da Saúde. INCA estima 704 mil casos de câncer por ano no Brasil até 2025 [Internet]. Disponível em: https://www.gov.br/inca/pt-br/assuntos/noticias/2022/inca-estima-704-mil-casos-de-cancer-por-ano-no-brasil-ate2025.
2. Allali S, Kirova Y. Radiodermatitis and Fibrosis in the Context of Breast Radiation Therapy: A Critical Review. Cancers (Basel). 2021;13(23):5928. doi: 10.3390/cancers13235928.
3. Bontempo PSM, Rodrigues MM, Maia GNL, Silva NCL, Gomes IP, Vasques CI, et al. Acute radiodermatitis in cancer patients: incidence and severity estimates. Rev Esc Enferm USP. 2021;55:e03676. doi: 10.1590/S1980-220X2019021703676.
4. Robijns J, Lodewijckx J, Mebis J. Photobiomodulation therapy for acute radiodermatitis. Curr Opin Oncol. 2019;31(4):291–8. doi: 10.1097/CCO.0000000000000511.
5. Censabella S, Claes S, Robijns J, Bulens P, Mebis J. Photobiomodulation for the management of radiation dermatitis: the DERMIS trial, a pilot study of MLS(®) laser therapy in breast cancer patients. Support Care Cancer. 2016;24(9):3925–33. doi: 10.1007/s00520-016-3232-0
6. Park J-H, Byun HJ, Lee JH, Kim H, Noh JM, Kim CR, et al. Feasibility of photobiomodulation therapy for the prevention of radiodermatitis: a single-institution pilot study. Lasers Med Sci. 2020;35(5):1119–27. doi: 10.1007/s10103-019-02930-1.
7. Robijns J, Censabella S, Claes S, Pannekoeke L, Bussé L, Colson D, et al. Biophysical skin measurements to evaluate the effectiveness of photobiomodulation therapy in the prevention of acute radiation dermatitis in breast cancer patients. Support Care Cancer. 2019;27(4):1245–54. doi: 10.1007/s00520-018-4487-4.
8. Robijns J, Lodewijckx J, Claes S, Van Bever L, Pannekoeke L, Censabella S, et al. Photobiomodulation therapy for the prevention of acute radiation dermatitis in head and neck cancer patients (DERMISHEAD trial). Radiother Oncol. 2021;158:268–75. doi: 10.1016/j.radonc.2021.03.002.
9. Strouthos I, Chatzikonstantinou G, Tselis N, Bon D, Karagiannis E, Zoga E, et al. Photobiomodulation therapy for the management of radiation-induced dermatitis. Strahlenther Onkol. 2017;193(6):491–8. doi: 10.1007/s00066-017-1117-x.
10. Pivetta HMF, et al. Atenção fisioterapêutica à mulher climatérica: aspectos de incontinência urinária e oncologia mamária. Santa Maria (RS): Universidade Federal de Santa Maria; 2014. 71 p.
11. Nugent SM, Lovejoy TI, Shull S, Dobscha SK, Morasco BJ. Associations of pain numeric rating scale scores collected during usual care with research administered patient reported pain outcomes. Pain Med. 2021;22(10):2235–41. doi: 10.1093/pm/pnab110.
12. Ramos Rocha S, da Costa Ferreira SA, Ramalho A, Conceição Gouveia Santos VL, Cristina Nogueira P. Photobiomodulation Therapy in the Prevention and Treatment of Radiodermatitis in Breast Cancer Patients: Systematic Review. J Lasers Med Sci. 2022;13:e42. doi: 10.34172/jlms.2022.42.
13. Noble-Adams R. Radiation-induced skin reactions. 2: Development of a measurement tool. Br J Nurs. 1999;8(18):1208–11. doi: 10.12968/bjon.1999.8.18.6490.
14. Cárcano CBM, de Oliveira CZ, Paiva BSR, Paiva CE. The Brazilian version of Skindex16 is a valid and reliable instrument to assess the health-related quality of life of patients with skin diseases. PLoS One. 2018;13(3):e0194492. doi: 10.1371/journal.pone.0194492.
15. Aguiar BRL, Guerra ENS, Normando AGC, Martins CC, Reis PEDD, Ferreira EB. Effectiveness of photobiomodulation therapy in radiation dermatitis: A systematic review and meta-analysis. Crit Rev Oncol Hematol. 2021;162:103349. doi: 10.1016/j.critrevonc.2021.
16. Zhang WW, Wang XY, Chu YX, Wang YQ. Light-emitting diode phototherapy: pain relief and underlying mechanisms. Lasers Med Sci. 2022;37(5):2343–52. doi: 10.1007/s10103-022-03540-0.
17. Hali F, El Kissouni A, Chiheb S, Charkaoui M, Berreda Y, Benchakroune N, Sahraoui S. Light-emitting diode therapy for the management of radiodermatitis. Our Dermatol Online. 2023;14(2):127–30. doi: 10.7241/ourd.20232.2.
18. Schlosser A, Maestri E, Cristina de Oliveira M, Frizon G, Felipette Lima J, Santos Candido TF, et al. Fotomodulação no processo de cicatrização de queimaduras: uma revisão integrativa. Sci Electronic Arch. 2023;16(11). doi: 10.36560/161120231810.
19. Cavalcante LG, Domingues RAR, Junior BO, Fernandes MAR, Pessoa EC, Abbade LPF. Incidence of radiodermatitis and factors associated with its severity in women with breast cancer: a cohort study. An Bras Dermatol. 2024;99(1):57–65. doi: 10.1016/j.abd.2023.01.004.
20. Vieira LAC, Menêses AG, Bontempo PSM, Simino GPR, Ferreira EB, Guerra ENDS, Reis PEDD. Incidence of radiodermatitis in breast cancer patients during hypofractionated radiotherapy. Rev Esc Enferm USP. 2022;56:e20220173. doi:10.1590/1980-220X-REEUSP-2022-0173en.
21. Anoop TM, Joseph PR, Pn M, Kp P, Gopan G, Chacko S. Cutaneous Toxicities in Breast Cancer Patients Receiving Chemotherapy and Targeted Agents--An Observational Clinical Study. Clin Breast Cancer. 2021;21(4):e434–47. doi: 10.1016/j.clbc.2021.01.009.
22. Seité S, Bensadoun RJ, Mazer JM. Prevention and treatment of acute and chronic radiodermatitis. Breast Cancer (Dove Med Press). 2017;9:551–7. doi: 10.2147/BCTT.S149752.
23. McDermott PN. Surface dose and acute skin reactions in external beam breast radiotherapy. Med Dosim. 2020;45(2):153–8. doi: 10.1016/j.meddos.2019.09.001.
