Jéssica Marim de Lima1, Mariana Callil Voos1,2, Isabela Pessa Anequini1, Fernando Alves Vale1, Fátima Aparecida Caromano1
1Programa de Pós-Graduação em Ciências da Reabilitação, Departamento de Fisioterapia, Fonoaudiologia e Terapia Ocupacional, Faculdade de Medicina, Universidade de São Paulo (USP), São Paulo, SP, Brasil
2Curso de Graduação em Fisioterapia, Departamento Teorias e Métodos em Fisioterapia e Fonoaudiologia, Pontifícia Universidade Católica de São Paulo (PUC), São Paulo, SP, Brasil
Recebido em: 20 de novembro de 2024; Aceito em: 10 de dezembro de 2024.
Correspondência: Fátima Aparecida Caromano, caromano@usp.br
Como citar
Lima JM, Voos MC, Anequini IP, Vale FA, Caromano FA. Por que os pacientes com calpainopatia perdem a marcha?. Fisioter Bras. 2024;25(6):1805-1819. doi:10.62827/fb.v25i6.1039
Resumo
Introdução: A calpainopatia é uma doença neuromuscular caracterizada por fraqueza muscular e atrofia muscular progressiva. Poucos estudos detalham as características de força muscular, amplitude de movimento e função motora em pacientes deambuladores e não deambuladores com calpainopatia. Objetivo: Identificar aspectos funcionais que distinguem pacientes com calpainopatia deambuladores e não deambuladores, considerando força muscular, amplitude de movimento e função motora. Métodos: Participaram 50 pacientes (16 - 56 anos, 26 não deambuladores e 24 deambuladores). Força muscular, amplitude de movimento, função motora e independência funcional foram mensurados. Resultados: Houve diferença significativa da força muscular dos grupos deambulador e não-deambulador nos segmentos de quadril, joelho, tornozelo e ombro bilateralmente, como esperado. Não houve diferença entre os grupos em relação à amplitude de movimento. Os escores médios totais da Medida de Independência Funcional para o grupo deambulador foram 106,0±11,3, enquanto o grupo não-deambulador pontuou 80,6±5,8. Conclusão: Foi possível descrever a condição funcional da amostra de pacientes brasileiros com calpainopatia e reconhecer biomarcadores funcionais relevantes, como força muscular e função motora, para a prática clínica e de pesquisa.
Palavras-chave: Distrofia muscular do cíngulo dos membros; estado funcional; força muscular, fisioterapia; manifestações neuromusculares.
Abstract
Introduction: Calpainopathy is a neuromuscular disease characterized by muscle weakness and progressive muscle atrophy. Few studies detail the characteristics of muscle strength, range of motion, and motor function in ambulator and non-ambulator patients with calpainopathy. Objective: To identify functional aspects that distinguish ambulator and non-ambulator patients with calpainopathy, considering muscle strength, range of motion and motor function. Methods: A total of 50 patients (16 - 56 years old, 26 non-ambulators and 24 ambulators) participated in the study. Muscle strength, range of motion, motor function, and functional independence were measured. Results: There was a significant difference in the muscle strength of the ambulator and non-ambulator groups in the hip, knee, ankle and shoulder segments bilaterally, as expected. There was no difference between the groups in terms of range of motion. The mean total scores of the Functional Independence Measure for the ambulator group were 106.0±11.3, while the non-ambulator group scored 80.6±5.8. Conclusion: It was possible to describe the functional condition of the sample of Brazilian patients with calpainopathy and to recognize relevant functional biomarkers, such as muscle strength and motor function, for clinical and research practice.
Keywords: Muscular dystrophies; functional status; muscle strength; physiotherapy; neuromuscular manifestation.
Introdução
A distrofia muscular de cinturas (DMC) reúne um grupo heterogêneo de desordens genéticas caracterizado por fraqueza muscular progressiva e atrofia simétrica, com predomínio na região do cíngulo dos membros superiores, membros inferiores e tronco [1]. Conforme a progressão da doença, pode ser acometida a musculatura distal dos membros, os músculos cardíacos e respiratórios [2].
Durante 10 anos, as distrofias musculares de cinturas foram classificadas como autossômica dominante (tipo 1) e autossômica recessiva (tipo 2). Essa nomenclatura utilizou as letras do alfabeto, de acordo com a identificação de mapeamento genético [3]. A partir de 2017, a classificação foi revista nomeando as DMC autossômicos dominantes como D e numerando-os de 1 a 5, e as formas recessivas como R com números de 1 a 23 [4,5].
A DMC tem incidência de 1-6 por 100.000 populações, existindo variabilidade de acordo com o subtipo da doença e o país de origem [6]. As formas autossômicas recessivas correspondem a 90% dos casos de DMC registrados [7]. Somente em 1989 foram mapeadas as primeiras famílias com mutação no gene CAPN3 (15q15.1), denominada calpainopatia, distrofia muscular de cintura-membro do tipo 2A e distrofia muscular de cintura-membro recessivo 1 [8,9]. O gene CAPN3, que codifica a calpaína 3, é uma protease de cisteína dependente de cálcio intracelular. É essencial na reparação e manutenção do músculo esquelético, pois modula atividades de várias enzimas intracelulares, participa na degradação de proteínas e no efluxo de cálcio do retículo sarcoplasmático [10,11].
O quadro clínico-funcional é de caráter progressivo, evolutivo, com início entre 8 e 15 anos e os primeiros sinais e sintomas são fraqueza muscular proximal, com predomínio em cíngulo pélvico [12]. Acredita-se, a partir de observações clínicas, que os pacientes com DMC adquirem adaptações musculares e biomecânicas que levam a movimentos compensatórios, com o objetivo de manter as atividades funcionais, mesmo que, com força muscular limitada, como descrito para pacientes com distrofia muscular de Duchenne [13].
A perda da marcha pode ser um marcador de incapacidade, com a progressão do curso clínico da doença [14]. Poucos estudos detalham as características de força muscular, amplitude de movimento e função motora em pacientes deambuladores e não deambuladores com calpainopatia. Trabalhamos com a hipótese de que existe uma linha tênue entre estas duas fases da doença, pois pode ocorrer a aquisição de movimentos e posturas compensatórias que permitam a deambulação, mesmo frente à perda significativa de força muscular em membros inferiores.
Os protocolos clínicos devem ser precisos para monitorar a progressão da fraqueza muscular e otimizar a função motora. Além disso, a tomada de decisão clínica depende da correta seleção de variáveis para acompanhar esses pacientes [15]. Estudos anteriores relataram correlações entre força muscular e função motora na distrofia muscular de Duchenne [16,17]. No entanto, a força muscular, função motora, amplitude de movimento e independência funcional e, mais especificamente, a perda da marcha não foram investigadas em pacientes com calpainopatia. Esses biomarcadores funcionais podem ser relevantes para o raciocínio clínico e acompanhamento de pacientes com doenças neuromusculares.
Identificou-se os aspectos funcionais que distinguem pacientes com calpainopatia deambuladores e não deambuladores, a partir do estudo da força muscular, amplitude de movimento e função motora.
Métodos
Participaram cinquenta pacientes com o diagnóstico de calpainopatia, de origem em diferentes regiões do Brasil, com diagnóstico confirmado por teste de DNA (NGS – Next Generation Sequencing Analysis). A idade dos pacientes variou de 16 a 56 anos. Foram divididos em dois grupos, o grupo não-deambulador (NAM) foi composto por 26 pacientes e o grupo deambulador (AM) com 24 pacientes. O tamanho da amostra foi determinado em 31 pacientes (alfa = 0,05 e beta = 0,20). Critérios de exclusão: Ausência de teste de DNA; presença de outra doença não associada à distrofia muscular de cinturas.
Foram coletadas informações sobre sexo, idade, idade de início dos sintomas e tempo de doença. A avaliação funcional incluiu medida de força muscular, amplitude de movimento passiva, função motora e independência funcional. Todos os pacientes foram avaliados por uma mesma examinadora (I.P.A.L.), com 10 anos de experiência na atividade.
A força muscular dos ombros, cotovelos, punhos, quadris, joelhos e tornozelos foi testada pelo teste de força muscular manual de Kendall, variando de 0 a 5 [18]. Zero indicava nenhuma contração muscular e cinco indicava força muscular normal. Os grupos musculares foram testados bilateralmente. As medidas do hemicorpo direito foram consideradas e as medidas de ambos os hemicorpos foram comparadas. Os escores de força muscular foram calculados por meio da fórmula proposta pelo Medical Research Council (MRC) [19]. Os índices para as regiões de membros superiores proximais, membros superiores distais, membros inferiores proximais e membros inferiores distais foram calculados, usando a fórmula:
Índice MRC (%) = Soma da força muscular X 100
Número de músculos testados X 5
A amplitude de movimento passiva de ombros, cotovelos, punhos, quadris, joelhos e tornozelos foi avaliada bilateralmente, por goniometria [20].
Todos os pacientes foram classificados pela Escala de Vignos (variando de 1 a 10) [21]. Os pacientes do grupo não-deambulador foram avaliados pela Escala de Egen Klassifikation (EK). A EK é uma escala ordinal em que zero representa o nível mais alto de independência funcional e 30 indica o nível mais baixo. A avaliação envolve a capacidade de usar cadeira de rodas, de se transferir da cadeira de rodas, de ficar em pé, de se equilibrar na cadeira de rodas, de movimentar os braços, de usar os membros superiores para comer, virar na cama, tossir, falar e bem-estar físico geral. Cada categoria tem quatro itens (pontuados de zero a três) [22]. Os pacientes do grupo deambulador foram avaliados por meio do teste de caminhada de 10 metros (10 MWT). Foram orientados a caminhar o mais rápido possível, em uma superfície plana e por uma distância pré-especificada. Para eliminar o componente de aceleração e desaceleração, solicitar aos voluntários que iniciassem a caminhada 1,2 m antes do início do percurso e a terminassem 1,2 m após os 10 m de percurso em velocidade usual e o tempo foi cronometrado pelo examinador [23].
A Escala de medida de independência funcional avaliou o nível de independência funcional nas atividades da vida diária em seis dimensões (autocuidado, controle esfincteriano, transferências, locomoção, comunicação e cognição social). A pontuação de todas as dimensões foi classificada em quatro grupos: dependência completa (0-18 pontos); dependência modificada (assistência em até 50% das tarefas, 19-60 pontos); dependência modificada (assistência para até 25% das tarefas, 61-103 pontos); independência completa / modificada (104-126 pontos). Pontuações mais altas denotam maior independência funcional [24].
Este estudo transversal foi desenvolvido pelo Laboratório de Fisioterapia e Comportamento do Programa de Pós-Graduação em Fisioterapia da Faculdade de Medicina da Universidade de São Paulo. Foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina da Universidade de São Paulo, Brasil, processo CAAE: 68790517.9.0000.0065. Recebeu apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior- Brasil (CAPES) - Código de financiamento 001.
A descrição dos dados incluiu média, desvio-padrão, valor máximo e mínimo.
Os testes de correlação de Pearson foram usados para analisar os dados paramétricos e os testes de correlação de Spearman foram usados para os dados não paramétricos. Foram analisadas correlações entre força muscular, amplitude de movimento, função motora e independência funcional [25,26]. Os coeficientes de correlação foram classificados como fortes (r<0,70), moderados (0,69> r≥0,40), fracos (0,39> r≥0,20) e desprezíveis (r <0,19) [27].
Os valores para a interpretação dos tamanhos do efeito (g = Hedges) foram efeito pequeno = 0,2, efeito médio = 0,5, efeito grande = 0,8.
O teste de Wilcoxon comparou a força muscular de hemicorpos dominantes e não dominantes. A análise estatística foi realizada no software Excel e o nível de significância adotado foi alfa <0,05.
Resultados
O grupo de deambuladores (ou ambulantes) (AM) foi formado por 24 pacientes e o grupo de não-deambuladores (ou não-ambulantes) (NAM) foi formado por 26 pacientes. Em relação à amostra total, a idade variou entre 18,2 e 58,7 anos (38,8 ± 12,0), com tempo de doença de 4,3 a 46,3 anos (24,0 ± 9,9) e idade de início dos sintomas de 2,6 a 39,0 anos (14,8 ± 8,3). A perda da marcha ocorreu entre 13,6 e 44,5 anos (27,4 ± 9,9).
Apesar da casuística ser heterogênea, os dois grupos (deambuladores e não-deambuladores) são compatíveis e comparáveis quanto às variáveis “idade” e “tempo de doença”. Os dados referentes à amostra encontram-se no Quadro 1.
Quadro 1 - Dados de idade, duração da doença, idade no início da doença e perda da marcha, em anos
|
Intervalo (anos) |
Mediana (anos) |
Média (anos) |
Desvio-padrão (anos) |
Valor de p (p) |
Tamanho do efeito (g) |
||
|
Idade |
Geral |
18,2 – 58,7 |
40,0 |
38,8 |
12,0 |
0,101 |
0,05 |
|
Deambulador |
18,2 – 58,7 |
34,2 |
35,8 |
13,6 |
|||
|
Não-deambulador |
21,0 – 54,7 |
41,4 |
40,3 |
12,3 |
|||
|
Duração |
Geral |
4,3 – 46,3 |
24,3 |
24,0 |
9,9 |
0,001 |
0,13 |
|
Deambulador |
4,3 – 36,3 |
19,3 |
19,0 |
8,6 |
|||
|
Não-deambulador |
13,3 – 46,3 |
28,3 |
28,1 |
10,2 |
|||
|
Idade de início |
Geral |
2,6 – 39,0 |
12,0 |
14,8 |
8,3 |
0,011 |
0,09 |
|
Deambulador |
6,9 – 39,0 |
12,8 |
16,8 |
9,5 |
|||
|
Não-deambulador |
2,6 – 29,2 |
11,0 |
12,2 |
6,7 |
|||
|
Idade de perda da marcha |
Não-deambulador |
13,6 – 44,5 |
28,8 |
27,4 |
9,9 |
1,000 |
0,00 |
Valor de p: obtido pelo teste de Kruskal-Wallis, Tamanho do efeito: teste de Hedge.
Os músculos mais afetados, considerando os diferentes segmentos dos membros superiores e inferiores, foram flexores de ombro, flexores de cotovelo, extensores de punho, extensores de quadril, flexores de joelho e dorsiflexores de tornozelo. A comparação da força muscular dos grupos AM e NAM mostrou diferença significativa para as medidas em relação aos segmentos de quadril, joelho, tornozelo e ombro bilateral com g forte para as medidas. Apenas o segmento cotovelo e punho do membro superior esquerdo apresentou tamanho de efeito moderado, enquanto para o membro superior direito não houve diferença entre os dois grupos. (Tabela 1).
Tabela 1 - Força do lado esquerdo/ lado direito
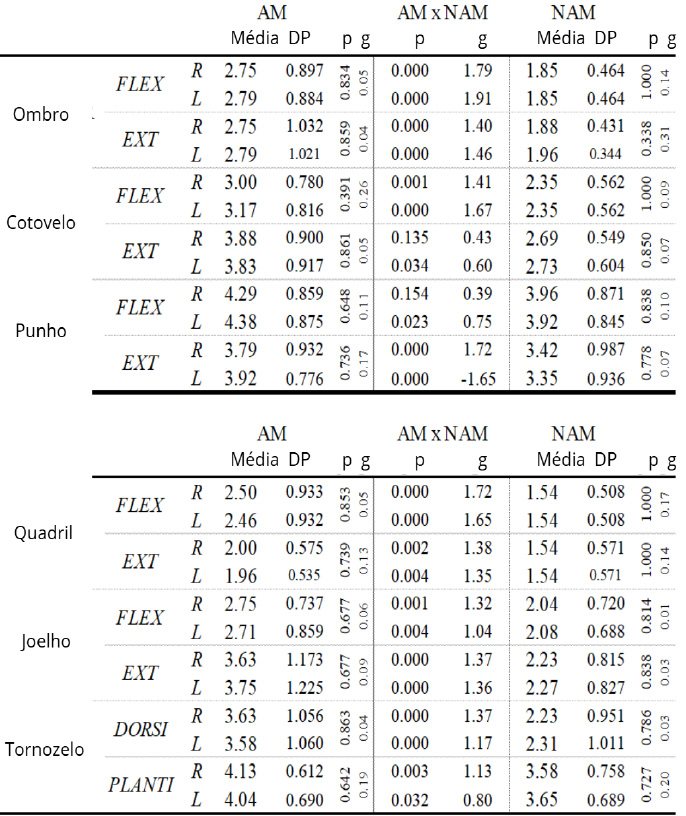
AM: grupo deambulador; NAM: grupo não deambulador; R: lado direito; L: lado esquerdo; p: p-value; g: Hedges’g effect size; valores verticais para p e g: lado esquerdo/ lado direito; AM x NAM: comparação para cada movimento de cada articulação.
A musculatura distal dos membros superiores e inferiores foi afetada posteriormente em ambos os grupos, independentemente da idade e/ou tempo de doença. Os dois grupos apresentaram diferença na força muscular manual entre os segmentos agonistas e antagonistas dos cotovelos e punhos, sendo predominante a força de extensão de cotovelo e flexão de punhos para ambos os grupos. O grupo NAM apresentou diferença na força muscular em segmento do ombro esquerdo, na mobilidade de flexão e extensão. Os músculos extensores do ombro esquerdo apresentaram força superior em relação aos músculos flexores. O grupo AM apresentou diferença na força muscular manual na região do quadril, na força dos músculos flexores superiores. A força de extensão do joelho também prevaleceu sobre a força de flexão, enquanto, para o grupo NAM, a diferença ocorreu apenas no predomínio da força muscular de plantiflexão sobre a dorsiflexão dos tornozelos (Tabela 2).
Tabela 2 - Força de flexão/ extensão
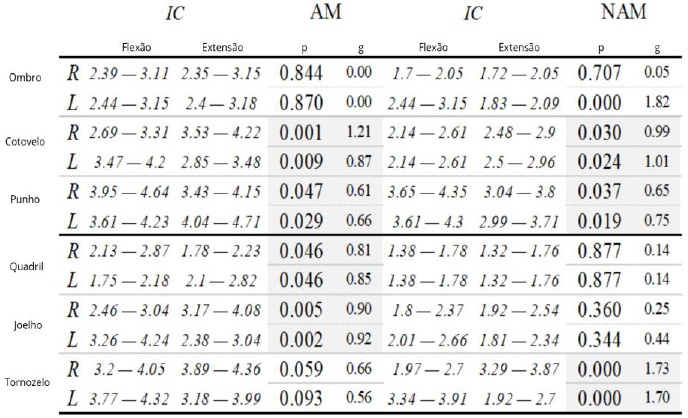
AM: grupo deambulador; NAM: grupo não deambulador; R: membro direito; L: membro esquerdo; IC: intervalo de confiança; p: valor de p; g: Hedges’g effect size.
Quando analisada a força muscular pelo cálculo da fórmula proposta pelo Medical Research Council, encontramos que, para os dois grupos, as medidas foram significativamente diferentes para todos os segmentos. No entanto, como o tamanho do efeito foi menor que 0.2 para todas as medidas, considera-se que essa diferença foi desprezível, mostrando que não havia diferença entre os grupos (Figura 1).
MRC: Medical Research Council; AM: grupo deambulador; NAM: grupo não deambulador; SHD: ombro; ELB: cotovelo; WRI: punho; KNE: joelho; ANK: tornozelo.
Figura 1 - Diferença da força muscular entre AM x NAM
Não houve diferença entre os grupos AM x NAM em relação à amplitude dos hemicorpos direito e esquerdo. Os valores não se afastam de forma relevante dos valores de normalidade, esperados para cada articulação pesquisada. Como a mudança foi pouco impactante na doença, esta variável não foi um bom biomarcador na avaliação motora e acompanhamento da evolução clínica. Os grupos AM x NAM apresentaram dados similares na amplitude de movimento. As variáveis não apresentaram correlações significativas.
Os grupos AM x NAM apresentaram média do escore da Escala de Vignos 3,2±1,3 e 7,1± 0,3, respectivamente. Destaca-se a correlação negativa moderada entre o escore da Escala de estadiamento de Vignos e o índice de força muscular (MRC) dos segmentos corpóreos de ombro (rho= -0.42 e p-value = 0,042) e joelho (rho= -0.51 e p-value= 0,011) para o grupo AM. Não houve correlação significativa entre as demais variáveis. Houve correlação negativa moderada entre o escore na Escala de Vignos e o escore total MIF do grupo AM (rho= -0.63) e o grupo NAM (rho= -0,43). Os nossos dados mostraram que houve correlação positiva moderada entre o escore na Escala de Vignos e o escore do TC10m (r= 0,68) para o grupo AM.
Quanto ao Escore pela Escala EK, o grupo NAM mostrou escore médio de 9,1±3,8. Não houve correlação significativa entre o escore da escala EK e as demais variáveis deste estudo.
No Teste 10MWT, considerando-se o grupo AM, observa-se média do escore da escala TC10m 17,4±7,3. Houve correlação negativa moderada entre o escore do TC10m e o índice de força muscular do segmento corpóreo de joelho (rho= -0,43), ou seja, a perda de força muscular segmentar interferiu no desempenho funcional nesta atividade para o AM.
O escore pela Escala MIF mostrou que o grupo AM apresentou média do escore total 106,0±11,3, enquanto o grupo NAM, 80,6±5,8. Houve correlação positiva moderada entre o escore total e o índice de força muscular do ombro (r= 0,60), cotovelo (r= 0,65), joelho (r= 0,56) e tornozelo (r= 0,41) para o grupo AM, e cotovelo (r=0,52) e quadril (r=0,56) para o NAM. Houve correlação negativa fraca entre o escore total da MIF e o índice de força muscular do quadril (r= 0,37) para o grupo AM, e do joelho (r=0,37) para o grupo NAM.
Discussão
Este estudo permitiu comparar as medidas funcionais em dois grupos (AM x NAM) de pacientes com calpainopatia que, embora funcionalmente diferentes, apresentavam época de aparecimento da doença e idade semelhantes. Portanto, eram compatíveis e comparáveis. Foram observados indivíduos que evoluíram precocemente com a perda da marcha.
Nossos resultados mostraram diferença da força muscular entre a flexão e extensão de cotovelos e punhos para ambos os grupos. Um estudo prévio avaliou um grupo de famílias que viviam na região sul da França, no estágio inicial da doença, com evidente fraqueza nos músculos do cíngulo escapular (latíssimo do dorso, romboides, serrátil, peitoral maior) [8]. Houve menor fraqueza no trapézio, deltoide, bíceps braquial e braquiorradial, que não são funcionalmente limitantes os pacientes carregarem cargas pesadas.
A descrição literária dos aspectos clínico-funcionais da calpainopatia ainda é baseada em informações escassas. Os profissionais de saúde não dispõem de ferramentas para avaliar medidas terapêuticas na prática clínica. Este estudo descreveu a relação entre força muscular, amplitude de movimento, função motora e independência funcional em 50 pacientes brasileiros com calpainopatia. Investigamos variáveis clinicamente relevantes, tais como idade do início dos sintomas e tempo de doença, para o acompanhamento desses pacientes. Este achado corrobora dados prévios de estudos feitos no Brasil (32%) e Itália (37%); e difere de outros países, incluindo Austrália (8%) e China (17%) [28-30].
Em um estudo conduzido nos Estados Unidos, foram avaliados pacientes com idade entre 11 e 37 anos [31]. No Japão foram avaliados pacientes com idade entre 9 e 84 anos, mostrando a longa sobrevida [32]. Em nossa amostra, a idade do início dos sintomas foi entre 2,6 e 39,0 anos (14,8±8,3). Outro estudo [8] mostrou início dos sintomas entre 3 e 30 anos, em uma pequena comunidade que vivia na região sul da Reunião da Ilha no Oceano Índico, indicando ser usual incluir todos os pacientes, independente da idade, de forma a localizar alterações funcionais relevantes com a evolução da doença.
Esses dados divergem da literatura: um estudo feito na China apresentou tempo de doença entre 1 e 28 anos [30]. A caracterização do grupo não-deambulador mostrou que a perda da marcha ocorreu entre 13,6 e 44,5 anos (27,4±9,9). Estudos tem estimado que a perda da marcha pode ocorrer entre 5 e 39 anos [33]. Esta variação é dependente do tempo de elaboração de diagnóstico preciso. Sáenz (2005) não observou correlação entre o início dos sintomas e o risco de perda da marcha. Esta informação corrobora nosso estudo [34]. Izco et al. (2005) relatam que os pacientes com DMC2A apresentaram mudanças espaço-temporais na marcha, incluindo diminuição da velocidade, cadência e comprimento dos passos [35].
Alguns autores destacam que existe grande variabilidade fenotípica entre pacientes com calpainopatia, mesmo entre membros da mesma família com a mesma mutação [36]. Albuquerque (2013) descreveu os aspectos clínicos, histológicos e moleculares em pacientes com DMC. Encontrou variabilidade na sintomatologia e evolução clínica da função motora entre irmãos gêmeos [2].
Os participantes do grupo não-deambulador apresentaram diferença de força muscular para o ombro esquerdo, mas não para o direito, enquanto o grupo deambulador não apresentou diferença flexo-extensora para o ombro. Esse dado corrobora um estudo feito em Taiwan, que mostrou na tomografia computadorizada envolvimento na musculatura do cíngulo escapular, incluindo supraespinhal, infraespinhal, trapézio, bíceps e tríceps [37].
O grupo deambulador apresentou essa diferença para os músculos de quadris (flexão > extensão) e joelhos (extensão > flexão), enquanto o grupo não-deambulador o apresentou apenas para tornozelos (plantiflexão > dorsiflexão). Em estudo feito na Espanha, observou-se que pacientes com distrofias musculares apresentavam fraqueza muscular distal (músculos gastrocnêmio e sóleo) associada a alterações significativas no movimento do tornozelo na fase inicial da marcha [35].
Quando comparada a força muscular individualizada, houve diferenças significativas entre os grupos, com g forte para quadris, joelhos, tornozelos e ombros. Em uma análise descritiva [38] da força muscular e função motora de pacientes com calpainopatia, os que deambulavam apresentaram força grau 2 e 3 em membros inferiores e os cadeirantes apresentaram grau 1 em região proximal e grau 2 na região distal. A Tabela 2 mostrou que não houve diferença entre os hemicorpos em ambos os grupos. Esta informação corrobora o estudo feito em pacientes com distrofia muscular de Duchenne, que não encontrou diferenças entre o membro dominante e o não dominante [39].
A amplitude de movimento não foi um biomarcador pertinente para o acompanhamento da doença na prática clínica, pois não apresentou correlação significativa com as demais variáveis deste estudo e apresentou dados similares entre os segmentos. Uma revisão sistemática estudou a amplitude de movimento funcional necessária para atividades de vida diária de ombro e cotovelo em pessoas saudáveis [40]. Evidenciou-se que, das 66 tarefas estudadas, as que exigem maior movimento do ombro foram pentear o cabelo e lavar a axila contralateral, do cotovelo foram usar o telefone, abrir a porta e girar o volante. Bergsma (2017) documentou as principais limitações e restrições das atividades de membros superiores em pacientes com doenças neuromusculares [41]. A maioria dos entrevistados apresentou fraqueza muscular e rigidez articular, que afetavam suas funções sociais, como, participação na escola ou trabalho (58%), atividades esportivas (47%), lazer (90%), serviços domésticos (89%) e relacionamento conjugal (80%).
Estudo feito em pacientes com DMC, com média do escore pela escala de Vignos 3,9 (deambuladores) e 6,9 (não deambuladores) [42], apresentou valores similares aos encontrados no presente estudo, indicando que, clinicamente, não existem variações relevantes entre amostras de pacientes brasileiros e chineses. Destaca-se a correlação negativa moderada entre o escore pela escala de Vignos e o escore funcional total do grupo AM (rho= -0.63) e o grupo NAM (rho= -0,43). Na escala funcional, quanto maior o valor de classificação do paciente, melhor o escore. Na escala de estadiamento de Vignos, quanto menor a classificação, melhor o escore funcional. Por isso, houve a correlação negativa. O uso da escala de Vignos no momento da avaliação funcional de pacientes com distrofia muscular de cinturas do tipo 2A pode reduzir o tempo da avaliação e fornece resultados confiáveis.
Os pacientes NAM apresentaram dificuldade em mover os braços para se locomover com a cadeira de rodas e fazer atividades contra a ação da gravidade. É importante a visão geral do paciente que, mesmo com a perda da marcha, evolui com comprometimento funcional de membros superiores [43].
Comparado ao tempo utilizado por adultos saudáveis, o grupo AM não apresentou lentidão considerável [23]. Chama atenção a correlação negativa moderada entre o escore do TC10m e o índice de força muscular do joelho (rho= -0,43). A perda de força muscular interferiu no desempenho funcional nesta atividade cronometrada para o grupo AM. Os nossos dados mostraram que houve correlação positiva moderada entre o escore pela escala de Vignos e do TC10m (r= 0,68). A Escala de Vignos é utilizada para classificar o estadiamento da doença. Conforme a progressão da doença, maior o tempo para o paciente percorrer o percurso de 10 metros.
Os pacientes do grupo NAM necessitaram da assistência de outrem para realizar suas tarefas rotineiras, devido comprometimento funcional. Na literatura, a compensação do movimento é definida como a adoção de estratégias comportamentais alternativas que permitem a execução da tarefa [44]. Essa seleção de estratégias depende da memória e da função executiva [45]. Chama atenção a correlação positiva moderada entre o escore funcional total e o índice de força muscular do ombro (r= 0,60), cotovelo (r= 0,65), joelho (r= 0,56) e tornozelo (r= 0,41) para o grupo AM, e, cotovelo (r=0,52) e quadril (r=0,56) para o grupo NAM. Pacientes com calpainopatia adquirem habilidades motoras para compensar a fraqueza muscular e lidar com as demandas funcionais.
. A solicitação proximal (quadril) no grupo AM e intermediária (joelho) para o grupo NAM, na marcha e nas transferências, talvez aconteça devido à readequação de sinergia de movimento, com o objetivo de manter a função e estabilizar as articulações adjacentes (tronco e tornozelo). Essas adaptações biomecânicas podem variar em cada fase do estágio da doença.
Esta pesquisa apresenta algumas limitações, incluindo o fato de que os músculos do tronco, face e respiratórios não terem sido avaliados, o que merece um estudo complementar. O percentual de força muscular calculado pela fórmula do Medical Research Council pode ser utilizado para uma avaliação global. Foi seguida a metodologia descrita por Kendall18, mas chamamos a atenção ao fato de que a avaliação da musculatura distal, especificamente os flexores/extensores de punho foi realizada com o paciente em sedestação estabilizando a musculatura proximal. Acreditamos que esta postura possa afetar o resultado da força muscular distal e que, o resultado poderia ser diferente se o paciente estivesse posicionado em decúbito dorsal.
Conclusão
Os escores de força muscular possuem correlação com a função motora. Houve comprometimento da força muscular do ombro e cotovelo, joelho e tornozelo, mostrando a necessidade de atenção especial no momento da avaliação clínica. É importante ressaltar que quando comparada a força muscular individualizada, entre os dois grupos, houve diferença significativa para medidas referentes aos quadris, joelhos, tornozelos e ombros. Não houve diferença significativa entre a força muscular dos hemicorpos direito e esquerdo.
A amplitude de movimento não apresentou correlação significativa com as outras variáveis deste estudo. É interessante considerar o fato de que os valores não se afastam de forma relevante dos valores preditos de normalidade, esperados para cada articulação pesquisada. Estes achados permitem indicar, com melhor embasamento, os biomarcadores funcionais a serem utilizados na prática clínica e de pesquisa para os grupos AM e NAM com calpainopatia.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse de qualquer natureza.
Fontes de financiamento
Financiamento Próprio.
Contribuição dos autores
Concepção e desenho de pesquisa: Lima JM, Voos MC, Anequini IP, Vale FA, Caromano FA; Coleta de dados: Lima JM, Anequini IP, Caromano FA; Análise e interpretação de dados: Lima JM, Voos MC, Caromano FA; Análise estatística: Voos MC; Redação do manuscrito: Lima JM, Voos MC, Anequini IP, Vale FA, Caromano FA; Revisão crítica do manuscrito quanto ao conteúdo intelectual importante: Lima JM, Voos MC, Caromano FA.
Referências
1. Zatz M, Paula F, Starling A, Vainzof M. The 10 autosomal recessive limb-girdle muscular dystrophies. Neuromuscular Disorders. 2003 Apr; 13(7-8): 532–44. https://doi. 10.1016/s0960-8966(03)00100-7
2. Albuquerque MAV. Distrofia muscular de cinturas em crianças: caracterização clínica, histológica e molecular [Tese]. São Paulo: Faculdade de Medicina, Universidade de São Paulo; 2013. [Internet]; [cited 2017 feb 17]. Available from https://www.teses.usp.br/teses/disponiveis/5/5138/tde-03012014-154533/publico/MarcoAntonioVelosodeAlbuquerque.pdf
3. Bonne G, Rivier F, Hamroun D. The 2019 version of the gene table of neuromuscular disorders (nuclear genome). Neuromuscular Disorders 2018; 28(12):1031-1063. 10.1016/j.nmd.2018.09.006
4. Straub, V.; Murphy, A.; Udd, B. 229th ENMC International Workshop: Limb Girdle Muscular Dystrophies - Nomenclature and Reformed Classification Naarden, The Netherlands, 17–19 March 2017. Neuromuscul Disord. 2018 Aug; 28(8):702-710. https://doi., https://doi.org/10.1016/j.nmd.2018.05.007
5. Angelini C. LGMD. Identification, description and classification. Acta Myol. 2020; 39:207-17. https://doi. 10.36185/2532-1900-024
6. Iyadurai SJ, Kissel JT. The Limb-Girdle Muscular Dystrophies and the Dystrophinopathies. Continuum (Minneap Minn). 2016 Dec;22(6):1954-1977. https://doi.10.1212/CON.0000000000000406
7. Mahmood OA, Jiang XM. Limb-girdle muscular dystrophies: where next after six decades from the first proposal (Review). Mol Med Rep. 2014 May;9(5):1515-32. https://doi.10.3892/mmr.2014.2048
8. Fardeau M, Hillaire D, Mignard C, Feingold N, Feingold J, Mignard D, et al. Juvenile limb-girdle muscular dystrophy Clinical, histopathological and genetic data from a small community living in the Reunion Island.Brain. 1996 Feb;119(1):295-308. https://doi.10.1093/brain/119.1.295
9. Landires I, Núñez-Samudio V, Fernandez J, Sarria C, Villareal V, Córdoba F, et al. Calpainopathy: Description of a Novel Mutation and Clinical Presentation with Early Severe Contractures. Genes (Basel). 2020 Feb; 11(2): 129. https://doi. 10.3390/genes11020129
10. Ojima K, Kono Y, Ottenheijim C, Chata S, Suzuki H, Granzier H, et al. Non-proteolytic functions of calpain-3 in sarcoplasmic reticulum in skeletal muscles. J Mol Biol. 2011 Apr; 407(3):439–49. https://doi.10.1002/pmic.201400386
11. Elgarresta JL, Mosqueira LM, Gastesi NN, Sáenz A, Munain AL, Illarramendi AV. Calcium Mechanisms in Limb-Girdle Muscular Dystrophy with CAPN3 Mutations. Int J Mol Sci. 2019 Sep; 20(18): 4548. https://doi.10.3390/ijms20184548
12. Urtasun M, Sáenz A, Roudaut C, Poza JJ, Urtizberea JA, Cobo AM, et al. Limb-girdle muscular dystrophy in Guipúzcoa (Basque Country, Spain). Brain. 1998 Sep;121(9):1735-47. https://doi.10.1093/brain/121.9.1735
13. Carvalho EV. Avaliação da responsividade da escala de avaliação funcional para distrofia muscular de Duchenne-domínio marcha [Tese]. São Paulo: Faculdade de Medicina, Universidade de São Paulo; 2017. [Internet]. [cited 2017 feb 17]. Available from https://repositorio.usp.br/item/002870125.
14. Beckmann JS, Bushby KMD. Advances in the molecular genetics of the limb-girdle type of autosomal recessive progressive muscular dystrophy. Curr Opin Neurol 1996; 9: 389–93. https://doi.10.1097/00019052-199610000-00013
15. Hukuda ME, Elaboração de confiabilidade de escala de avaliação do sentar e levantar da cadeira para portadores de distrofia muscular de Duchenne (DMD) [Tese]. São Paulo: Faculdade de Medicina, Universidade de São Paulo; 2009. [Internet]. [cited 2017 feb 17]. Available from https://www.teses.usp.br/teses/disponiveis/5/5163/tde-09122009-162729/pt-br.php
16. Nunes MF, Hukuda ME, Favero FM, Oliveira AB, Voos MC, Caromano FA. The relationship between muscle strength and motor function in Duchenne muscular dystrophy. Arq Neuro-Psiquiatr. 2016 Jul; 74(7), 530-535. https://doi.10.1590/0004-282X20160085
17. Bendixen RM, Lott DJ, Senesac C, Mathur S, Vandenborne K. Participation in daily life activities and its relationship to strength and functional measures in boys with Duchenne muscular dystrophy. Disabil Rehabil. 2014 Feb;36(22):1918-23. https://doi.10.3109/09638288.2014.883444
18. Kendall FP, McCreary EK, Provance PG. Músculos: provas e funções. 5 ed. São Paulo: Manole; 2007. [Internet]. [cited 2017 feb 17]. Available from https://www.manole.com.br/musculos-provas-funcoes-5-edicao/p
19. Diniz GPC, Lasmar LM, Giannetti JG. Motor assessment in patients with Duchenne muscular dystrophy. Arq Neuro-Psiquiatr. 2012 Jun; 70(6):416-421. doi:10.1590/s0004-282x2012000600007
20. Reese N, Bandy W, (Joint Range of Motion and Muscle Length Testing 3rd Edition). Editora: Saunders, 2016. https://doi.10.1590/s0004-282x2012000600007
21. Vignos PJ Jr, Archibald KC. Maintenance of ambulation in childhood muscular dystrophy. J. Chronic Dis. 1960; 12:273-89. https://doi.10.1016/0021-9681(60)90105-3
22. Steffensen B, Hyde S, Lyager S, Mattson E. Validity of the EK scale: a functional assessment of non-ambulatory individuals with Duchenne muscular dystrophy or spinal muscular atrophy. Physiother Res Int. 2001 Mar; 6:119-34. https://doi. 10.1002/pri.221
23. Swank C, Almutairi S, Medley A. Proposing Development and Utility of a Mobility Composite Measure in Patients with a Neurologic Disorder. Rehabil Res Pract. 2017 Oct; 2017:1-7. https://doi. 10.1155/2017/8619147
24. Viana FP, Lorenzo AC, Oliveira EF, Resende SM. Medida de independência funcional nas atividades de vida diária em idosos com seqüelas de acidente vascular encefálico no Complexo Gerontológico Sagrada Família de Goiânia. Rev Bras Geriatr Gerontol. 2008 Jan; 11(1):17-28. https://doi.org/10.1590/1809-9823.2008.11013
25. Ellis, PD. (2010). The Essential Guide to Effect Sizes: Statistical Power, Meta-Analysis, and the Interpretation of Research Results. 1 ed. Cambridge: Cambridge University Press; 2010. doi: https://doi.org/10.1017/CBO9780511761676
26. Espírito-Santo HA, Daniel F. Calcular e apresentar tamanhos do efeito em trabalhos científicos (1): As limitações do p < 0,05 na análise de diferenças de médias de dois grupos. Revista Portuguesa de Investigação Comportamental e Social. 2015;1(1):3-16. https://doi.org/10.1017/CBO9780511761676
27. McGraw KO, Wong SP. A common language effect size statistic. Psychological Bulletin. 1992; 111(2): 361-365. https://doi.org/10.1037/0033-2909.111.2.361
28. Magri F, Del Bo R, D’Angelo MG, Sciacco M, Gandossini S, Govoni A, et al. Frequency and characterization of anoctamin 5 mutations in a cohort of Italian limb-girdle muscular dystrophy patients. Neuromuscul Disord. 2012 Nov; 22(11):934-943. https://doi. 10.1016/j.nmd.2012.05.001
29. Lo HP, Cooper ST, Evesson FJ, Seto JT, Chiotis M, Tay V, et al. Limb-girdle muscular dystrophy: diagnostic evaluation, frequency and clues to pathogenesis. Neuromuscul Disord. 2008 Jan; 18(1):34-44. https://doi. 10.1016/j.nmd.2007.08.009
30. Mahmood OA, Jiang XM, Zhang Q. Limb-girdle muscular dystrophy subtypes: first-reported cohort from northeastern China. Neural Regen Res. 2013 Jul; 8 (20):1907-1918. https://doi. 10.3969/j.issn.1673-5374.2013.20.010
31. Dincer P, Akcoren Z, Demir E, Richard I, Sancak O, Kale G, et al. A cross section of autosomal recessive limb-girdle muscular dystrophies in 38 families. Journal of Medical Genetics. 2000; 37(5):361-367. https://doi. 10.1136/jmg.37.5.361
32. Mori-Yoshimura M, Segawa K, Minami N, Oya Y, Komaki H, Nonaka I, et al. Cardiopulmonary dysfunction in patients with limb-girdle muscular dystrophy 2A. Muscle Nerve. 2017 Apr;55(4):465-469. https://doi. 10.1002/mus.25369
33. Murphy AP, Straub V. The Classification, Natural History and Treatment of the Limb Girdle Muscular Dystrophies. J Neuromuscul Dis. 2015 Jul 22; 2(2):S7-S19. https://doi. 10.3233/JND-150105
34. Sáenz A, Leturcq F, Cobo AM, Poza JJ, Ferrer X, Otaegui D, et al. LGMD2A: genotype-phenotype correlations based on a large mutational survey on the calpain3 gene. Brain.2005 Apr; 128(Pt 4):732-42. https://doi.org/10.1093/brain/awh408
35. Izco FM, Iriarte MM, Aldea JJP, Massó JFM, de Munain AL. Análisis de la marcha y del movimiento de las extremidades superiores en distrofias musculares. Neurología: 2005; [Internet]. 20(7):341-348. [cited 2017 feb 17]. Available from https://repositorio.unip.br/wp-content/uploads/2020/12/V30_n2_2012_p176-180.pdf
36. Zatz M, Starling A. Calpains and disease. N Engl J Med. 2005 Jun; 352(2): 2413-423. https://doi. 10.1056/NEJMra043361
37. Liang WC, Jong YJ, Wang CH, Wang CH, Tian X, Chen WZ, et al. Clinical, pathological, imaging, and genetic characterization in a Taiwanese cohort with limb-girdle muscular dystrophy. Orphanet J Rare Dis. 2020 Jun 23;15(1):160. https://doi. 10.1186/s13023-020-01445-1
38. Shin JH, Kim HS, Lee CH, Kim CM, Park KH, Kim DS. Mutations of CAPN3 in Korean Patients with Limb-Girdle Muscular Dystrophy. J Korean Med Sci. 2007 Jun; 22(3): 463–469. https://doi. 10.3346/jkms.2007.22.3.463
39. Artilheiro MC, Sá CSC, Fávero FM, Caromano FA, Voos MC. Patients with Duchenne and Becker muscular dystrophies are not more asymmetrical than healthy controls on timed performance of upper limb tasks. Braz J Med Biol Res. 2017 Jul;50(8): e6031. https://doi. 10.1590/1414-431X20176031
40. Oosterwijk AM, Nieuwenhuis MK, van der Schans CP, Mouton LJ. Shoulder and elbow range of motion for the performance of activities of daily living: A systematic review. Physiother Theory Pract. 2018 Jan 29:1-24. https://doi. 10.1080/09593985.2017.1422206
41. Bergsma A, Janssen MMHP, Geurts ACH, Cup EHC, de Groot IJM. Different profiles of upper limb function in four types of neuromuscular disorders. Neuromuscul Disord. 2017; 27(12):1115-1122. https://doi. 10.1016/j.nmd.2017.09.003
42. Lue YJ, Lin RF, Chen SS, Lu YM. Measurement of the functional status of patients with different types of muscular dystrophy. Kaohsiung J Med Sci. 2009 Jun;25(6):325-33. https://doi. 10.1016/S1607-551X(09)70523-6
43. Fagoaga J, Girabent-Farrés M, Bagur-Calafat C, Steffensen BF. Evolución de la capacidad functional valorada con la escala Egen Klassifikation en personas afectas de atrofia muscular espinal o distrofia muscular de Duchenne de la población española: estudio longitudinal de tres años. Rev Neurol. 2015; 61(8):344-348. https://doi. 10.33588/rn.6108.2015319
44. Martini J, Voos MC, Hukuda ME, Resende MBD, Caromano FA. Compensatory movements during functional activities in ambulatory children with Duchenne muscular dystrophy. Arq Neuro-Psiquiatr. 2014 Jan;72(1): 5-11. https://doi. 10.1590/0004-282X20130196
45. Finsterer J. Calpainopathy Can manifest itself in not only skeletal muscle but also the brain and myocardium. Intern Med. 2024 May 30. doi: 10.2169/internal medicine.3919-24. Epub ahead of print. PMID: 38811215. https://doi. 10.2169/internalmedicine.3919-24